東北大学多元物質科学研究所の渡部聡助教、稲葉謙次教授、サン・ラファエル研究所(イタリア)のシティア教授らの共同研究グループは、細胞中で分泌タンパク質の品質管理を担うERp44というタンパク質について、中性および酸性条件下における立体構造をX線結晶構造解析によって決定し、細胞内のpH変化に応答したERp44の構造変化を明らかにしました。構造解析の結果、保存された複数のヒスチジン残基(タンパク質を構成するアミノ酸の一つ)が、pH変化に伴いプロトン化状態(水素原子が一つ結合した状態)を安定化することによって、全体のドメイン配置や局所的な構造変化が誘起され、分子表面の電荷分布が大きく変化することが分かりました。またERp44が様々な未成熟の分泌タンパク質を捉える仕組みも明らかになりました。本研究により、細胞内の分泌経路におけるタンパク質品質管理機構の一端が分子構造レベルで深く解明されました。
本論文は、米国科学誌「米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America)」のオンライン版において、2017年4月3日午後3時(米国東部時間)に公開されました。
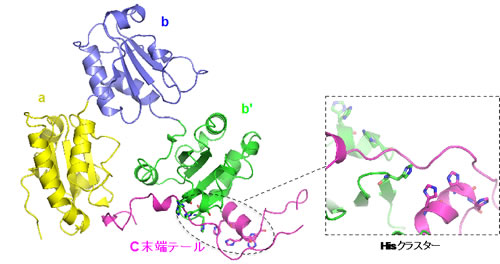
ERp44の立体構造

