発表のポイント
- 触媒の近接環境で選択的に進行するタンパク質化学修飾反応の新しいツールを開発。
- 従来の手法とは異なる新たなアプローチでタンパク質のヒスチジン残基を迅速に化学修飾することに成功。
- ナノメートルスケールの局所環境で抗体分子を部位選択的に機能化することに成功。
- 細胞内のタンパク質の位置関係を明らかにする手法への応用が期待される。
概要
タンパク質の化学構造に不可逆的な強い結合(共有結合)で機能を導入する技術「タンパク質化学修飾」は、タンパク質を用いるバイオマテリアル創出や、ドラックデリバリーシステム開発において必要不可欠な技術です。
東北大学学際科学フロンティア研究所の佐藤伸一助教らのグループは、東京工業大学科学技術創成研究院の中村浩之教授、東北大学大学院生命科学研究科の石川稔教授らと共同で、タンパク質に対する新しい化学修飾反応を開発しました。本手法では活性酸素種の一種である一重項酸素1) を利用することで、特定座標の周辺に存在するヒスチジン残基を迅速に機能化します。一重項酸素を活用する本手法は、局所空間内に存在するタンパク質を機能化する新たな戦略として、タンパク質研究を加速させると期待できます。
この研究成果に関する論文は2021年4月27日付けでJournal of the American Chemical Society 誌のオンライン速報版で公開されました。
東北大学学際科学フロンティア研究所の佐藤伸一助教らのグループは、東京工業大学科学技術創成研究院の中村浩之教授、東北大学大学院生命科学研究科の石川稔教授らと共同で、タンパク質に対する新しい化学修飾反応を開発しました。本手法では活性酸素種の一種である一重項酸素1) を利用することで、特定座標の周辺に存在するヒスチジン残基を迅速に機能化します。一重項酸素を活用する本手法は、局所空間内に存在するタンパク質を機能化する新たな戦略として、タンパク質研究を加速させると期待できます。
この研究成果に関する論文は2021年4月27日付けでJournal of the American Chemical Society 誌のオンライン速報版で公開されました。
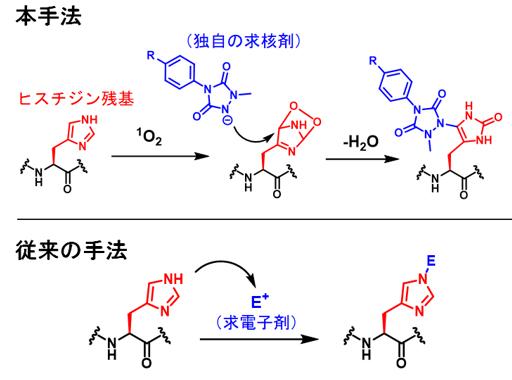
図1 本手法によるヒスチジン残基修飾法と従来法の違い
<論文情報>
著者:Keita Nakane, Shinichi Sato*, Tatsuya Niwa, Michihiko Tsushima, Shusuke Tomoshige, Hideki Taguchi, Minoru Ishikawa, and Hiroyuki Nakamura
タイトル:Proximity Histidine Labeling by Umpolung Strategy Using Singlet Oxygen
掲載誌名:Journal of the American Chemical Society
DOI: 10.1021/jacs.1c01626
【お問い合わせ先】
(研究に関すること)
東北大学学際科学フロンティア研究所(兼大学院生命科学研究科)
担当 佐藤 伸一(さとう しんいち)
E-mail: shinichi.sato.e3(at)tohoku.ac.jp
【報道に関すること】
東北大学学際科学フロンティア研究所 企画部
担当 鈴木 一行(すずき かずゆき)
Tel: 022-795-4353
E-mail: suzukik(at)fris.tohoku.ac.jp

