クライオ電子顕微鏡を用いて、血管収縮作用を持つペプチドホルモンであるエンドセリンについて、その受容体およびGタンパク質(細胞膜上で情報伝達を担うタンパク質)との複合体構造を調べ、細胞間での情報伝達メカニズムを明らかにしました。
ヒトは約60兆個の細胞で構成されており、細胞間での情報交換が協調的に行われることで、正常な生命活動を維持しています。各細胞は細胞膜に包まれ、細胞外からのさまざまなシグナルは、細胞膜の受容体タンパク質によって細胞内に伝えられます。血管収縮作用を持つペプチドホルモンであるエンドセリン(ET)については、細胞膜に存在するエンドセリンB型受容体(ETBR)との結合構造が解明されていますが、ETBRとGタンパク質(細胞膜上で情報伝達を担うタンパク質)の天然結合状態の複合体構造は未解明であり、情報伝達メカニズムも十分に理解されていません。
本研究では、クライオ電子顕微鏡を用いて、ET、ETBR、Gタンパク質の複合体構造を観察しました。その結果、Gタンパク質とETBRが強く結合する構造が明らかになりました。また、Gタンパク質の種類を識別するメカニズムや、受容体の活性化に関わる要因を解明しました。
本研究成果は、ETによる細胞情報伝達メカニズムの理解を深めるだけでなく、立体構造に基づいた新しい薬剤設計に役立つと期待されます。
本研究では、クライオ電子顕微鏡を用いて、ET、ETBR、Gタンパク質の複合体構造を観察しました。その結果、Gタンパク質とETBRが強く結合する構造が明らかになりました。また、Gタンパク質の種類を識別するメカニズムや、受容体の活性化に関わる要因を解明しました。
本研究成果は、ETによる細胞情報伝達メカニズムの理解を深めるだけでなく、立体構造に基づいた新しい薬剤設計に役立つと期待されます。
研究代表者
筑波大学 計算科学研究センター
谷 一寿 教授
沖縄科学技術大学院大学 イメージングセクション (当時)
ブルーノ・ホンベル 博士
東京大学 大学院農学生命科学研究科
寺田 透 教授
理化学研究所 放射光科学研究センター/東北大学 多元物質科学研究所
米倉 功治 グループディレクター/教授
京都大学 大学院理学研究科
土井 知子 博士
谷 一寿 教授
沖縄科学技術大学院大学 イメージングセクション (当時)
ブルーノ・ホンベル 博士
東京大学 大学院農学生命科学研究科
寺田 透 教授
理化学研究所 放射光科学研究センター/東北大学 多元物質科学研究所
米倉 功治 グループディレクター/教授
京都大学 大学院理学研究科
土井 知子 博士
研究の背景
エンドセリン(ET)は21のアミノ酸残基から成るペプチドホルモンで、血管収縮作用があります。エンドセリン受容体注1)は、細胞膜に存在するタンパク質で、細胞内外の分子と相互作用して、細胞間の情報伝達に関与します。細胞外からエンドセリンが受容体に結合すると、受容体の構造はGタンパク質(細胞膜上で情報伝達を担うタンパク質)と相互作用しない不活性型から、Gタンパク質と相互作用できる柔軟な初期活性型に変化します。その後、受容体構造はGタンパク質と複合体を形成して完全活性化型に移行します。この複合体形成を通してGタンパク質の構造にも変化が起こり、Gタンパク質のαサブニットに結合していたGDPはGTPに交換され、Gタンパク質が活性化されることで、細胞内の応答(情報伝達)が引き起こされます(図1)。エンドセリンにはET-1、ET-2、ET-3の3種類があり、このうちET-1は主に血管内皮細胞で産生され、周囲の細胞や自己の細胞に取り込まれ、血圧を調節し血流を一定に保つ局所的な血流調節に寄与します。さらに、体液の恒常性維持や神経発生、細胞増殖などにも重要な役割を果たします。エンドセリンは、高血圧症、動脈硬化症、心不全、腎不全、がんなど多様な病態に関与しており、その作用機構を正しく理解し適切に調節することで、病態の軽減が期待されます。
2016年にX線構造解析を用いて決定されたエンドセリンとその受容体の結合構造が解明されて以来、さまざまな状態の受容体の立体構造が明らかになっています。一方、エンドセリンに関する情報伝達機構については、昨年2つの研究グループにより、NanoBiTシステム注2)を用いて複合体構造が明らかにされましたが、天然結合状態の様式は依然として明らかになっておらず、薬剤開発につなげるための知見が不足しています。
2016年にX線構造解析を用いて決定されたエンドセリンとその受容体の結合構造が解明されて以来、さまざまな状態の受容体の立体構造が明らかになっています。一方、エンドセリンに関する情報伝達機構については、昨年2つの研究グループにより、NanoBiTシステム注2)を用いて複合体構造が明らかにされましたが、天然結合状態の様式は依然として明らかになっておらず、薬剤開発につなげるための知見が不足しています。
研究内容と成果
エンドセリン受容体は、細胞膜に埋め込まれているGタンパク質共役型受容体(GPCR)注3)の一種で、細胞膜から取り出すと変性しやすい特性があります。そこで、ヒトのエンドセリン受容体の安定性や剛直性を高めるために、5つの点変異(一塩基の変異)を導入した変異体(Y5-ETB)を開発し、これを用いて、X線結晶解析により受容体とエンドセリンの複合体構造を決定することに成功しました。しかし、5つのうち4つの点変異を元の野生型に戻すと、複合体の分解能は低下し、アミノ酸残基の位置を特定することはできませんでした。最終的に、ドミナントネガティブ注4)と呼ばれる変異を導入して安定化したGタンパク質ファミリーの一つであるGi注5)(DNGi)を用いたところ、受容体とGiの間にNanoBiTシステムによる Giの安定化がなくても安定な複合体を形成させることに成功しました。さらに、クライオ電子顕微鏡注6)でこの複合体を分析し、アミノ酸残基が可視化できる分解能で、立体構造を決定することができました(図2)。
この構造解析により、三量体Gタンパク質のαサブニット(Gαi)(図3a:マゼンタ色リボン)のC末端側の特徴的なフック構造(C351-F354)、それに続く10残基(D341-D350)がET-1結合受容体タンパク質(ETBR)の細胞質側結合ポケットにぴったりと収まり、結合している様式が明らかになりました(図3a)。また、ETBRとGαiの相互作用領域は、既知のG-GPCR複合体構造と比較して少なく、主にGαのC末端側のみが関与していることが分かりました(図3b)。この相互作用の多くは、どのGαでも保存されているアミノ酸配列によって行われるため、選択性が比較的低く、様々なGαと反応できることを説明できます。一方で、Gαの種類によって異なる相互作用領域もわずかながら存在し、特に受容体のICL2領域がGタンパク質の種類を見分ける可能性が示唆されました。
また、GPCRにおいて、7番目の膜貫通領域で保存されているアミノ酸配列(NPxxY)が、ETBRではユニークな配列NPxxLとなっています。本解析で得られた完全活性型ET-1結合ETBRを不活性型ETBR 構造と比較すると、NPxxL領域が活性化に伴って細胞質側に動くというユニークな構造変化を起こしていることが分かり(図4a, b)、このロイシン(L)部分は受容体の完全活性化やGα結合ポケットの形成に重要であることが、生化学実験や分子動力学シミュレーションによって実証されました(図4c)。
この構造解析により、三量体Gタンパク質のαサブニット(Gαi)(図3a:マゼンタ色リボン)のC末端側の特徴的なフック構造(C351-F354)、それに続く10残基(D341-D350)がET-1結合受容体タンパク質(ETBR)の細胞質側結合ポケットにぴったりと収まり、結合している様式が明らかになりました(図3a)。また、ETBRとGαiの相互作用領域は、既知のG-GPCR複合体構造と比較して少なく、主にGαのC末端側のみが関与していることが分かりました(図3b)。この相互作用の多くは、どのGαでも保存されているアミノ酸配列によって行われるため、選択性が比較的低く、様々なGαと反応できることを説明できます。一方で、Gαの種類によって異なる相互作用領域もわずかながら存在し、特に受容体のICL2領域がGタンパク質の種類を見分ける可能性が示唆されました。
また、GPCRにおいて、7番目の膜貫通領域で保存されているアミノ酸配列(NPxxY)が、ETBRではユニークな配列NPxxLとなっています。本解析で得られた完全活性型ET-1結合ETBRを不活性型ETBR 構造と比較すると、NPxxL領域が活性化に伴って細胞質側に動くというユニークな構造変化を起こしていることが分かり(図4a, b)、このロイシン(L)部分は受容体の完全活性化やGα結合ポケットの形成に重要であることが、生化学実験や分子動力学シミュレーションによって実証されました(図4c)。
今後の展開
本研究により解明された完全な活性化型構造情報は、受容体を活性化する小分子リガンド注7)化合物や抗体医薬など、副作用の少ない中分子薬の設計につながると期待されます。また、別の型のエンドセリン受容体であるETAに関しても、NanoBiTシステムを用いない天然の分子機構を解明できれば、ETA型とETB型それぞれのサブタイプに対して選択性の高い作動薬開発が可能になると考えられます。
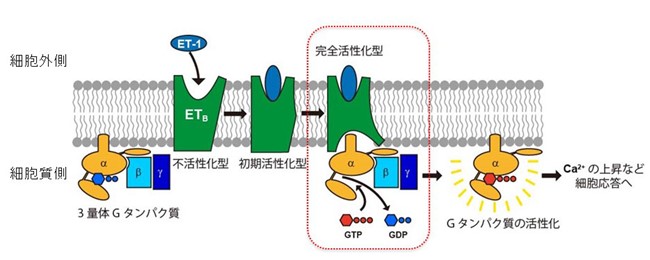
図1 エンドセリン受容体の活性化スキーム。細胞外からエンドセリン(ET-1)が細胞膜上の受容体(ETB)に結合すると、細胞内の三量体Gタンパク質のGDPがGTPに交換され、Gタンパク質が活性化される。その結果、細胞内のカルシウムイオン濃度上昇などの、細胞応答が誘導される。
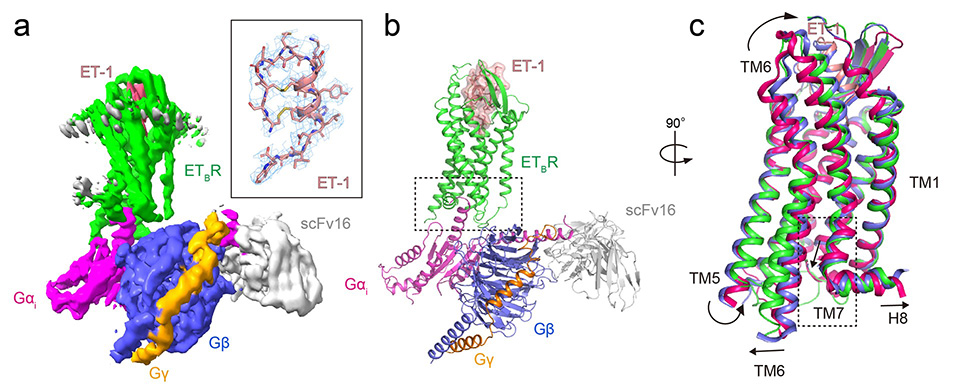
図2 クライオ電子顕微鏡により可視化されたET-1–ETBR–Gαi複合体の立体構造。(a) デンシティマップ注8)。 (b) タンパク質の種類ごとに色分けしたリボンモデル。 (c) 活性化状態に応じたETBRの構造変化。不活性化型(赤)、ET-1結合型の初期活性化状態(青)、ET-1–Gαi結合型の完全活性化型状態(緑)。(b)および(c)の破線部分の詳細は、それぞれ図3(a)、図4(a)に対応する。
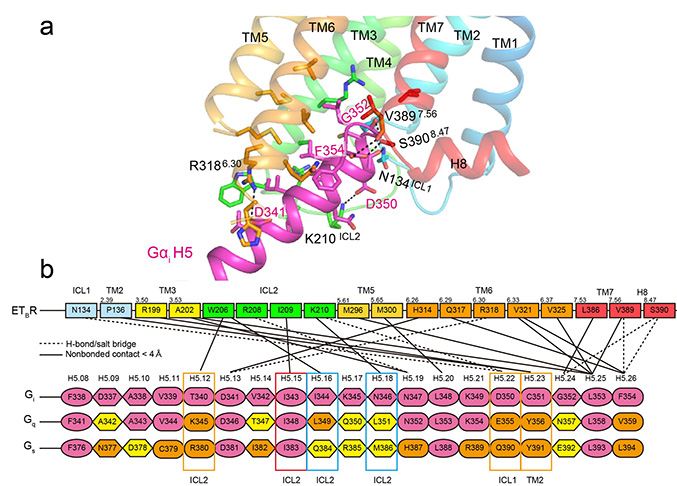
図3 エンドセリン受容体(ETBR)とGαi複合体のカルボキシル(C)末端側の結合様式。(a) 相互作用しているアミノ酸残基。破線は水素結合を示す。受容体はレインボー色、GαiのC末端はマゼンタで表す。(b) 相互作用部分のアミノ酸配列。Giを基準に、GqやGsなどの異なるGαタンパク質で同一アミノ酸配列の場合はマゼンタ、性質の似たアミノ酸配列の場合はオレンジ、異なるアミノ酸配列の場合は黄色で表す。細胞内側ループ領域注9)ICL1よりもICL2の方が、相互作用しているGαタンパク質のアミノ酸残基が種類に応じて変化する場合が多い。
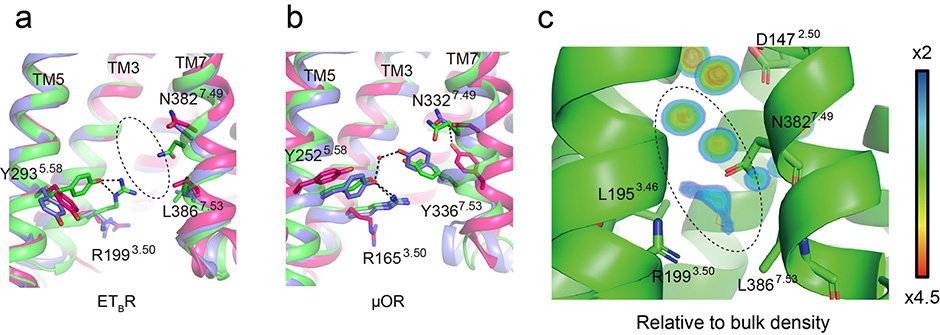
図4 受容体の細胞質側付近における膜貫通部位の構造変化。(a, b) それぞれエンドセリンB型受容体(ETBR)とμオピオイド受容体(μOR)の不活性型(赤)、初期活性化型(青)、完全活性化型(緑)を重ねて表示している。μORでは、7番目の膜貫通領域に存在するTyr336が5番目の膜貫通領域に近付き、水素結合を形成しているが、ETBRでは対応するアミノ酸残基はLeu386であり、この部分には破線領域の空間が存在する。(c) 活性型ETBRの構造に対する分子動力学シミュレーションにより得られた、タンパク質の近傍に存在する水分子の占有率。(a)および(c)の破線部分に水分子が存在することが示唆される。
用語解説
注1) エンドセリン受容体
細胞表面の膜に存在するタンパク質で、細胞外からエンドセリンを結合することで活性化され、細胞内にさまざまな応答を引き起こす。
注2) NanoBiTシステム
細胞内でのタンパク質間相互作用を検出するために開発された技術。発光酵素を分割し、それぞれの標的タンパク質に融合させ、標的タンパク質同士で相互作用が起こる際に生じる発光現象を利用して、分子間相互作用を検出することができる。
注3) Gタンパク質共役型受容体(GPCR)
細胞膜上に存在する膜タンパク質で、神経伝達物質やホルモンを受容することで構造を変化させ、細胞内のシグナル分子を介して情報を伝達する。細胞膜を7回貫通する特徴的な構造を持つことから、「7回膜貫通型受容体」とも呼ばれる。現在使用されている薬剤のおよそ半数以上がGPCRに関連しており、医薬品のターゲットとしても注目されている。
注4) ドミナントネガティブ
複数のサブユニットで構成される複合体において、変異型のサブユニットが組み込まれると、正常なタンパク質の機能が阻害され、複合体全体の機能が著しく損なわれることがある。このような変異型をドミナントネガティブという。構造解析においてGPCRとGタンパク質の結合状態を安定化させるための手法として用いられる。
注5) Gi
Gタンパク質の中で、主に細胞内シグナル伝達において抑制的な役割を担う重要な分子で、多くのシグナル伝達経路においてさまざまな細胞機能を抑制する。心筋細胞など特定の細胞において、カリウムチャネルを活性化し、心拍数の低下や抑制的な神経伝達などをもたらす。
注6) クライオ電子顕微鏡(Cryo-EM)
超低温で生体の高分子構造を立体的に解析する手法の一つ。本研究では、理化学研究所のSPring-8に設置されたCRYO-ARM300と、沖縄科学技術大学院大学のTalos Arcticaを使用した。
注7) リガンド
特定の受容体と結合する化学物質の総称。受容体を活性化するものと、不活性化するものの2種類がある。特に、可逆的な相互作用を通じて受容体を活性化し、特定の生理作用を引き起こすリガンドを作動薬と呼ぶ。
注8) デンシティマップ
原子や分子による電荷の分布を示したもので、クライオ電子顕微鏡などを用いて得られた実験データから計算により求められる。このマップ(図1a)に従って原子モデル(図1b)が構築される。
注9) ループ領域
生体高分子の構造において、αヘリックスやβシートといった二次構造の間に存在するフレキシブルな部分で、屈曲や輪の立体構造を形成する。特に、エンドセリン受容体の細胞内側ループ領域は、Gタンパク質との相互作用に重要であり、N末端側から順にICL1, ICL2, ICL3と番号付けされることが多い。
細胞表面の膜に存在するタンパク質で、細胞外からエンドセリンを結合することで活性化され、細胞内にさまざまな応答を引き起こす。
注2) NanoBiTシステム
細胞内でのタンパク質間相互作用を検出するために開発された技術。発光酵素を分割し、それぞれの標的タンパク質に融合させ、標的タンパク質同士で相互作用が起こる際に生じる発光現象を利用して、分子間相互作用を検出することができる。
注3) Gタンパク質共役型受容体(GPCR)
細胞膜上に存在する膜タンパク質で、神経伝達物質やホルモンを受容することで構造を変化させ、細胞内のシグナル分子を介して情報を伝達する。細胞膜を7回貫通する特徴的な構造を持つことから、「7回膜貫通型受容体」とも呼ばれる。現在使用されている薬剤のおよそ半数以上がGPCRに関連しており、医薬品のターゲットとしても注目されている。
注4) ドミナントネガティブ
複数のサブユニットで構成される複合体において、変異型のサブユニットが組み込まれると、正常なタンパク質の機能が阻害され、複合体全体の機能が著しく損なわれることがある。このような変異型をドミナントネガティブという。構造解析においてGPCRとGタンパク質の結合状態を安定化させるための手法として用いられる。
注5) Gi
Gタンパク質の中で、主に細胞内シグナル伝達において抑制的な役割を担う重要な分子で、多くのシグナル伝達経路においてさまざまな細胞機能を抑制する。心筋細胞など特定の細胞において、カリウムチャネルを活性化し、心拍数の低下や抑制的な神経伝達などをもたらす。
注6) クライオ電子顕微鏡(Cryo-EM)
超低温で生体の高分子構造を立体的に解析する手法の一つ。本研究では、理化学研究所のSPring-8に設置されたCRYO-ARM300と、沖縄科学技術大学院大学のTalos Arcticaを使用した。
注7) リガンド
特定の受容体と結合する化学物質の総称。受容体を活性化するものと、不活性化するものの2種類がある。特に、可逆的な相互作用を通じて受容体を活性化し、特定の生理作用を引き起こすリガンドを作動薬と呼ぶ。
注8) デンシティマップ
原子や分子による電荷の分布を示したもので、クライオ電子顕微鏡などを用いて得られた実験データから計算により求められる。このマップ(図1a)に従って原子モデル(図1b)が構築される。
注9) ループ領域
生体高分子の構造において、αヘリックスやβシートといった二次構造の間に存在するフレキシブルな部分で、屈曲や輪の立体構造を形成する。特に、エンドセリン受容体の細胞内側ループ領域は、Gタンパク質との相互作用に重要であり、N末端側から順にICL1, ICL2, ICL3と番号付けされることが多い。
研究資金
本研究は、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS:JP21am0101118, JP21am0101116, JP22ama121006, JP23ama121004, JP23ama121027)、JST未来社会創造事業(JPMJMI23G2)、科研費(JP20H03210)、京都大学リサーチ・デベロップメントプログラム いしずえ2019、量子情報生命科学研究センター等の支援を受けて実施されました。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS:JP21am0101118, JP21am0101116, JP22ama121006, JP23ama121004, JP23ama121027)、JST未来社会創造事業(JPMJMI23G2)、科研費(JP20H03210)、京都大学リサーチ・デベロップメントプログラム いしずえ2019、量子情報生命科学研究センター等の支援を受けて実施されました。
掲載論文
Kazutoshi Tani, Saori Maki-Yonekura, Ryo Kanno, Tatsuki Negami, Tasuku Hamaguchi, Malgorzata Hall, Akira Mizoguchi, Bruno M. Humbel, Tohru Terada, Koji Yonekura & Tomoko Doi (2024) Structure of endothelin ETB receptor-Gi complex in a conformation stabilized by unique NPxxL motif. Communications Biology
関連リンク
【問い合わせ先】
(研究に関すること)
東北大学 多元物質科学研究所
教授 米倉 功治(よねくら こうじ)
電話: 022-217-5380
Email:koji.yonekura.a5(at)tohoku.ac.jp
東北大学 多元物質科学研究所
教授 米倉 功治(よねくら こうじ)
電話: 022-217-5380
Email:koji.yonekura.a5(at)tohoku.ac.jp
(報道に関すること)
東北大学多元物質科学研究所 広報情報室
TEL: 022-217-5198
Email: press.tagen(at)grp.tohoku.ac.jp
TEL: 022-217-5198
Email: press.tagen(at)grp.tohoku.ac.jp

東北大学は持続可能な開発目標(SDGs)を支援しています

