

| top | 研究内容 | 研究業績 | 研究トピックス | メンバー | English |
|
主な研究課題 薬剤耐性関連蛋白質Drp35の構造機能解析 Drp35(a 35-kDa drug-responsive protein)は,黄色ブドウ球菌が細胞壁合成阻害系の抗生物質や界面活性剤に曝された際に発現される蛋白質であり,そのため,薬剤耐性に関与すると考えられている.既往の研究から,Ca2+依存性のラクトナーゼ活性を有することが知られている(Scheme1). 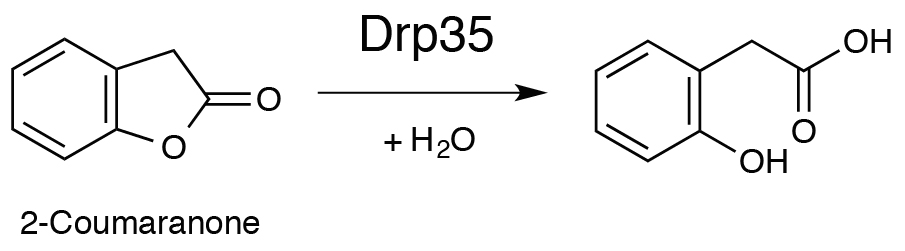 Scheme1.Drp35によるラクトンの加水分解反応 我々は,Drp35のラクトナーゼ活性発現機構を解明するために,Drp35の立体構造解析と変異体解析を行った.構造解析の結果,Drp35はsix-bladed b-propeller構造を有しており,2つのCa2+が結合していることがわかった(図.1).Ca2+は中心部分と分子表面に結合していたが,ホモログ蛋白質間で保存されている残基の変異体の活性を比較した結果から,中心部分のCa2+が活性に重要であることがわかった.活性部位周辺の残基の更なる変異体解析とD138N変異体の構造解析から,Ca2+とAsp138,Asp236が関与する新規なラクトナーゼ活性発現機構が提案された(図.2). 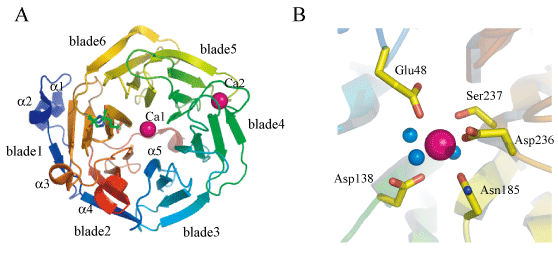 図2.Drp35の立体構造 (A)全体構造(B)活性部位周辺の構造(青の球は水分子) 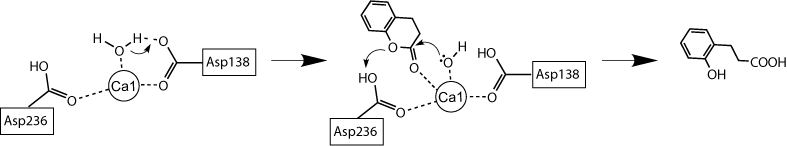 図3.提案されたDrp35の活性発現機構 |