

| top | 研究内容 | 研究業績 | 研究トピックス | メンバー | English |
|
主な研究課題 細胞表層蛋白質Ebhの立体構造解析 黄色ブドウ球菌は20種類の細胞表層蛋白質を有しているが,その中でとりわけ分子量の大きな蛋白質としてEbh(extracellular matrix binding protein homologue)が見出された.Ebhは約1.1 MDaの巨大蛋白質であり,機能ドメインとして126残基からなるコア配列を52回繰り返して有している.本研究では,X線結晶構造解析,円偏光二色性,小角X線散乱によりEbhの構造を解析した.2つのドメインが連結した蛋白質のX線結晶構造解析を行った結果, three-helix bundle構造の各ドメインが縦方向に連続して結合した,約120Aの棒状の構造であることが明らかになり,ドメイン間には,ある程度のフレキシビリティが確認された(図.1, 2).次に,1,2,4,10個のドメインが連結した蛋白質を調製し,各々の蛋白質について小角X線散乱による構造解析を行ったところ,いずれの分子も溶液中で棒状の分子として存在しており,またドメインの数が増えるにつれて分子長が長くなることが明らかになった(図.3).各蛋白質の円偏光二色性スペクトルが完全に一致したことから(図.4),各々のドメインは同一の構造を有していることが示された.以上の結果から,全長のEbhがドメイン間でフレキシビリティをもった約320nmのひも状の分子であることが提案された. 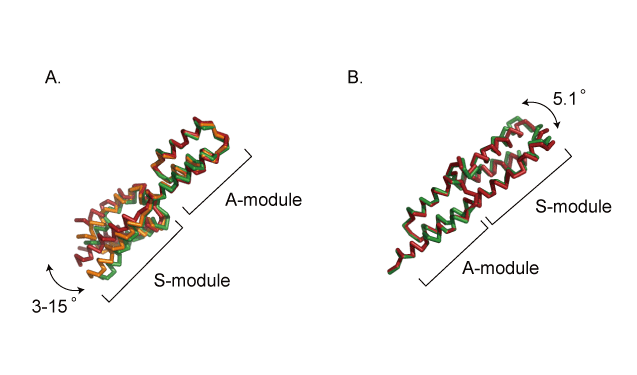 図1.7番目と8番目のドメインが連結した蛋白質の立体構造 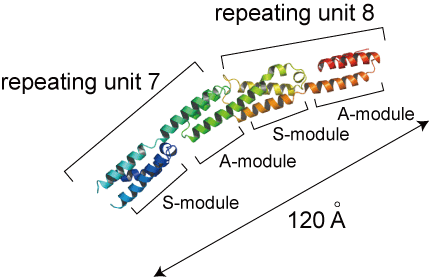 図2.ドメイン間のフレキシビリティ (A)S module - A module間のフレキシビリティ (B)A module ? S module間のフレキシビリティ 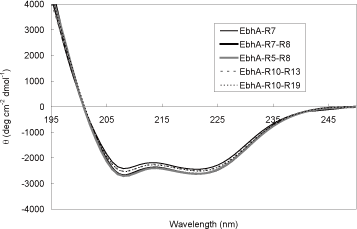 図3.ドメインの数の異なる各蛋白質の円偏光二色性スペクトル 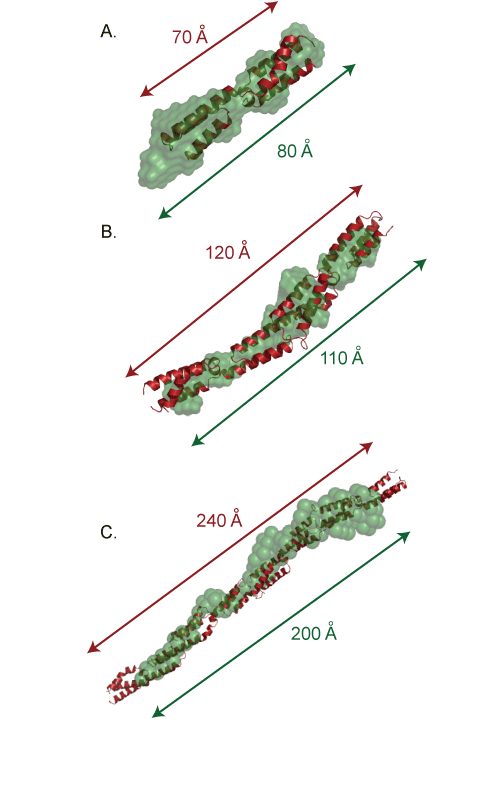 図4.小角X線散乱法により得られた各蛋白質の溶液構造 緑:小角X線散乱のモデル,赤:X線結晶構造解析から推察される構造 (A)ドメインが1つの蛋白質 (B)ドメインが2つの蛋白質 (C)ドメインが4つの蛋白質 |