発表のポイント
- ゴルジ体(注1)に亜鉛を取り込むヒト由来亜鉛トランスポーター(注2)ZnT7の立体構造をクライオ電子顕微鏡単粒子解析(注3)により、最高2.2 Å分解能という個々のアミノ酸がはっきりみえる分解能において、世界で初めて決定しました。
- ゴルジ体に亜鉛を放出する外向き型構造および細胞質から亜鉛を取り込む内向き型構造、さらには異なる複数の亜鉛結合状態の立体構造を決定し、亜鉛輸送の一連のスナップショットを捉えることに成功しました。
- ZnT7が膜貫通ヘリックス(注4)中の亜鉛結合部位に亜鉛を受け渡す分子機構を解明しました。
概要
亜鉛は全ての生物において必須の微量金属イオンであり、分子レベルではタンパク質の立体構造形成や酵素の触媒機能、細胞や個体のレベルでは、遺伝子発現の制御、正常な成長、生殖機能、健康維持において重要な役割を担っています。東北大学多元物質科学研究所のHan Ba Bui学術研究員、渡部聡助教、稲葉謙次教授らの研究グループは、これまで、ゴルジ体に局在して亜鉛を運ぶ分子である亜鉛トランスポーターZnT7やZnT5/6, ZnT4が、ゴルジ体における亜鉛濃度を厳密に制御していることを明らかとしてきました。しかし、これら亜鉛トランスポーターの立体構造は未決定であり、亜鉛輸送の詳細なメカニズムは未解明でした。
今回、同研究グループは、クライオ電子顕微鏡単粒子解析を用いて、亜鉛トランスポーターZnT7の立体構造を2.2Å分解能という高分解能で構造決定することに世界で初めて成功しました。
さらに、亜鉛を放出する直前および直後の立体構造を捉えることにも成功し、亜鉛輸送の一連のステップのほぼ全ての可視化に成功しました。亜鉛トランスポーターファミリーの一般的な分子機構の解明につながることが期待されるばかりか、細胞内の亜鉛恒常性維持機構に関する理解が格段に進みました。
本研究成果は、2023年8月8日に科学雑誌Nature Communicationsに掲載されました。
なお、本研究成果は東北大学大学院情報科学研究科の木下賢吾教授、医学系研究科の加藤幸成教授、京都大学大学院医学研究科の野村紀通准教授、岩田想教授、および東京大学大学院医学系研究科の吉川雅英教授らとの共同研究により得られたものです。
今回、同研究グループは、クライオ電子顕微鏡単粒子解析を用いて、亜鉛トランスポーターZnT7の立体構造を2.2Å分解能という高分解能で構造決定することに世界で初めて成功しました。
さらに、亜鉛を放出する直前および直後の立体構造を捉えることにも成功し、亜鉛輸送の一連のステップのほぼ全ての可視化に成功しました。亜鉛トランスポーターファミリーの一般的な分子機構の解明につながることが期待されるばかりか、細胞内の亜鉛恒常性維持機構に関する理解が格段に進みました。
本研究成果は、2023年8月8日に科学雑誌Nature Communicationsに掲載されました。
なお、本研究成果は東北大学大学院情報科学研究科の木下賢吾教授、医学系研究科の加藤幸成教授、京都大学大学院医学研究科の野村紀通准教授、岩田想教授、および東京大学大学院医学系研究科の吉川雅英教授らとの共同研究により得られたものです。
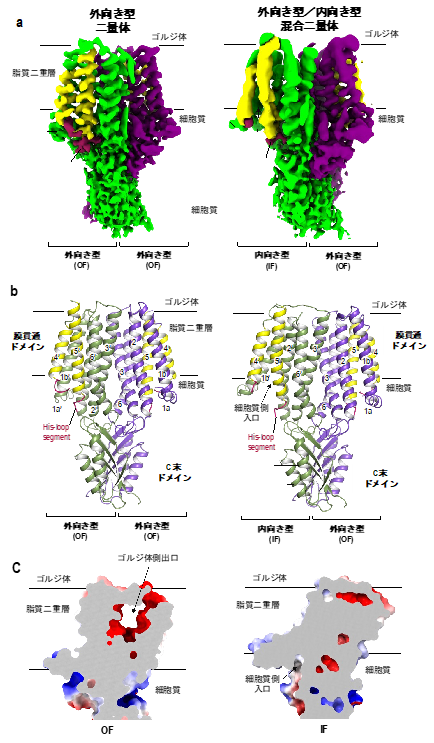
図1. ZnT7ニ量体のクライオ電子顕微鏡マップ(a)、分子構造モデル(b)、静電電荷マップの断面図(c)。
外向き型構造では、ゴルジ体側に亜鉛を放出する出口が形成される。一方、内向き型構造では、細胞質側から亜鉛を取り込むための入口が形成される。
外向き型構造では、ゴルジ体側に亜鉛を放出する出口が形成される。一方、内向き型構造では、細胞質側から亜鉛を取り込むための入口が形成される。
【用語説明】
注1.ゴルジ体
細胞内小器官の一つであり、シス、中間、トランスの層板構造を持つ。小胞体からゴルジ体に輸送されてきた分泌タンパク質は、糖鎖修飾や部位特異的切断、金属イオンの配位などを受ける。最近の研究から、ゴルジ体では遊離亜鉛濃度が20~100 nMと他の細胞内小器官に比べて高い濃度で保たれていることが判明した。
細胞内小器官の一つであり、シス、中間、トランスの層板構造を持つ。小胞体からゴルジ体に輸送されてきた分泌タンパク質は、糖鎖修飾や部位特異的切断、金属イオンの配位などを受ける。最近の研究から、ゴルジ体では遊離亜鉛濃度が20~100 nMと他の細胞内小器官に比べて高い濃度で保たれていることが判明した。
注2.亜鉛トランスポーター
生体膜を隔てて亜鉛イオンの輸送を行う膜内在性のタンパク質。細胞外やオルガネラ内腔から細胞質方向へ亜鉛イオンを輸送するZIPファミリー、その反対方向へ輸送するZnTファミリーの2種類が知られる。
生体膜を隔てて亜鉛イオンの輸送を行う膜内在性のタンパク質。細胞外やオルガネラ内腔から細胞質方向へ亜鉛イオンを輸送するZIPファミリー、その反対方向へ輸送するZnTファミリーの2種類が知られる。
注3.クライオ電子顕微鏡単粒子解析
タンパク質の立体構造を高分解能で決定するための手法の一つ。電子線照射による分子の振動や損傷を抑えるために、観測対象のタンパク質を氷薄膜中に包埋し、マイナス180度の低温に保ったまま電子顕微鏡像を観測する。個々の分子像は、様々な向きで氷薄膜に包埋された分子の投影像であり、数十万から数百万分子の投影像を分類・平均化し、それらを統合して高分解能の三次元構造を構築することができる。
タンパク質の立体構造を高分解能で決定するための手法の一つ。電子線照射による分子の振動や損傷を抑えるために、観測対象のタンパク質を氷薄膜中に包埋し、マイナス180度の低温に保ったまま電子顕微鏡像を観測する。個々の分子像は、様々な向きで氷薄膜に包埋された分子の投影像であり、数十万から数百万分子の投影像を分類・平均化し、それらを統合して高分解能の三次元構造を構築することができる。
注4. 膜貫通ヘリックス
生体膜中に存在する多くの膜タンパク質は、膜貫通領域にαヘリックスと呼ばれるらせん状の規則正しい構造を複数含んでいる。特に膜を介して物質を輸送する膜トランスポーターは、膜貫通ヘリックスの中に物質を取り込み、膜貫通へリックスの配向を巧みに変化させ、物質を効率よく放出すると考えられている。
生体膜中に存在する多くの膜タンパク質は、膜貫通領域にαヘリックスと呼ばれるらせん状の規則正しい構造を複数含んでいる。特に膜を介して物質を輸送する膜トランスポーターは、膜貫通ヘリックスの中に物質を取り込み、膜貫通へリックスの配向を巧みに変化させ、物質を効率よく放出すると考えられている。
【論文情報】
Han Ba Bui, Satoshi Watanabe, Norimichi Nomura, Kehong Liu, Tomoko Uemura, Michio Inoue, Akihisa Tsutsumi, Hiroyuki Fujita, Kengo Kinoshita, Yukinari Kato, So Iwata, Masahide Kikkawa, *Kenji Inaba (2023) Cryo-EM structures of human zinc transporter ZnT7 reveal the mechanism of Zn2+ uptake into the Golgi apparatus.
DOI: 10.1038/s41467-023-40521-5
DOI: 10.1038/s41467-023-40521-5
関連リンク
【問い合わせ先】
(研究に関すること)
東北大学多元物質科学研究所
担当 稲葉 謙次(いなば けんじ)
電話番号: 022-217-5604
Eメール: kenji.inaba.a1(at)tohoku.ac.jp
(報道に関すること)
東北大学多元物質科学研究所広報情報室
電話番号: 022-217-5198
Eメール: press.tagen(at)grp.tohoku.ac.jp
(研究に関すること)
東北大学多元物質科学研究所
担当 稲葉 謙次(いなば けんじ)
電話番号: 022-217-5604
Eメール: kenji.inaba.a1(at)tohoku.ac.jp
(報道に関すること)
東北大学多元物質科学研究所広報情報室
電話番号: 022-217-5198
Eメール: press.tagen(at)grp.tohoku.ac.jp

