発表のポイント
- 血中濃度が高まると動脈硬化の原因となることから一般に悪玉コレステロールとも呼ばれる低比重リポタンパク質(LDL)コレステロールは、LDL受容体と結合して細胞内に取り込まれて分解される。
- そのLDL受容体が、細胞内で翻訳合成されつつ、正しい立体構造に折り畳まれていく様子を観察することに初めて成功した。
- LDL受容体の立体構造形成は、従来考えられていたよりも、遥かに早く進行することが明らかになった。
- 本受容体を構成するあるドメイン注1)の立体構造形成は、それよりも下流に存在する領域によって制御されていることを初めて見出した。
- LDL受容体の折り畳みの新たな機構が判明したことから、ある種の家族性高コレステロール血症発症メカニズムの理解を進めることが期待される。
概要
LDL受容体は、動脈硬化を促進するLDLに結合し細胞内に取り込むタンパク質です。LDL受容体の立体構造形成に問題が生じると、高コレステロール血症、ひいては脳梗塞、心筋梗塞などの疾患の原因になります。東北大学多元物質科学研究所の門倉広准教授、稲葉謙次教授らのグループは、ヒト低比重リポタンパク質(LDL)受容体が、細胞内で翻訳合成されつつ、正しい立体構造に折りたたまれていく様子を観察することに初めて成功しました。今回の結果から、LDL受容体の立体構造形成は、従来の見解より早い段階(翻訳合成中)において、精緻な制御のもと進行することがわかりました。本研究で得られた知見は、LDL受容体上の変異によって高コレステロール血症が発症する仕組みを理解するための基盤になると期待されます。
本研究成果は、米国科学アカデミー紀要オンライン版に、6月29日(米国東部時間)付けで公開されました。
詳細な説明
私たちの体を構成している細胞は、細胞内で働くタンパク質だけでなく、細胞膜や細胞の外で働くタンパク質も多く作っています。このようなタンパク質は細胞表層タンパク質と呼ばれます。細胞表層タンパク質には、後述する低比重リポタンパク質(LDL)受容体など、私たちが健康な生活を送る上で欠かせない、様々なタンパク質が含まれます。細胞表層タンパク質の多くは、その分子内にジスルフィド結合と呼ばれる構造を持ちます。ジスルフィド結合とはタンパク質上の2個のシステインと呼ばれるアミノ酸が酸化されて作られる分子内の架橋構造です。ジスルフィド結合は多くの細胞表層タンパク質が正しい構造に折り畳まれる上で極めて重要な役割を担っています。細胞表層タンパク質へのジスルフィド結合の導入は、ヒト細胞中ではPDIファミリータンパク質注2)と呼ばれる一群の酵素によって触媒され、小胞体と呼ばれる細胞内小器官のなかで、進行します。しかし、ヒト細胞の小胞体に送り込まれてくる翻訳合成途上のタンパク質に、いつ、どのようにしてジスルフィド結合が導入されるのかについてはほとんど分かっていませんでした。この仕組みを解明するためのモデルタンパク質として、私たちは上述のLDL受容体を用いました。LDL受容体は複数のドメインからなる膜タンパク質(図1)であり、ジスルフィド結合は、7個のRドメインと3個のEGFドメインの各々に3本ずつ存在します。LDL受容体は血液中のLDLと結合し、細胞内に取り込むタンパク質です。このタンパク質が正しい立体構造に折りたたまれないと、高コレステロール血症、ひいては脳梗塞、心筋梗塞などの疾患が引き起こされることが知られています。したがって、LDL受容体が折りたたまれる仕組みを解明することは、基礎と応用の両面から重要だと考えられます。
本論文で、私たちは、リボソーム上で翻訳合成されつつ小胞体内で伸長するLDL受容体のポリペプチド鎖にジスルフィド結合が導入される過程を観察するための系を構築することに成功しました。この系を用いた解析から、LDL受容体のポリペプチド鎖が全長の約40%の長さにまで伸長し、先のRドメインが小胞体中に出現すると、天然構造にはない誤った組み合わせのシステイン間にジスルフィド結合が導入されることが分かりました(図1、フェーズ①)。更に、LDL受容体が全長の約57%の長さにまで伸長し下流に存在するβ-プロペラと呼ばれるドメインの一部が合成されると、これが引き金になって、先のRドメイン中に導入されていた非天然型のジスルフィド結合が正しい結合へと組み換えられることを発見しました(図1、フェーズ②)。
ジスルフィド結合の組み換え反応は、複数のドメインから構成されるタイプの様々な細胞表層タンパク質の立体構造形成において鍵となる反応ステップで、従来は、タンパク質の翻訳合成が終わった後、数十分の時間をかけてゆっくりと進行すると信じられてきました。本研究から、この反応は、これまでに考えられていたよりも遥かに早い段階(タンパク質の翻訳合成中)において、精緻な制御のもと、進行しうることが初めて明らかになりました。
タンパク質の立体構造形成の途上にある分子は変性しやすいことが知られています。よって、LDL受容体は正しい立体構造に早く到達することによって、自身の変性のリスクを低減させていると考えられます。複数のドメインからなる、他の多くの細胞表層タンパク質においても、これまで調べられてこなかっただけで、実際には、翻訳合成反応の進行とともに、速やかに折りたたまれている可能性があります。
LDL受容体は、血中に存在するLDLに結合し細胞内に取り込むタンパク質です。LDL受容体の立体構造形成に問題が生じると、高コレステロール血症、ひいては脳梗塞、心筋梗塞などの疾患の原因になることが知られています。よって、本受容体の立体構造形成上の問題によって病気が引き起こされている場合には、本研究で得られた知見は、その仕組みを理解するための基盤になると期待されます。
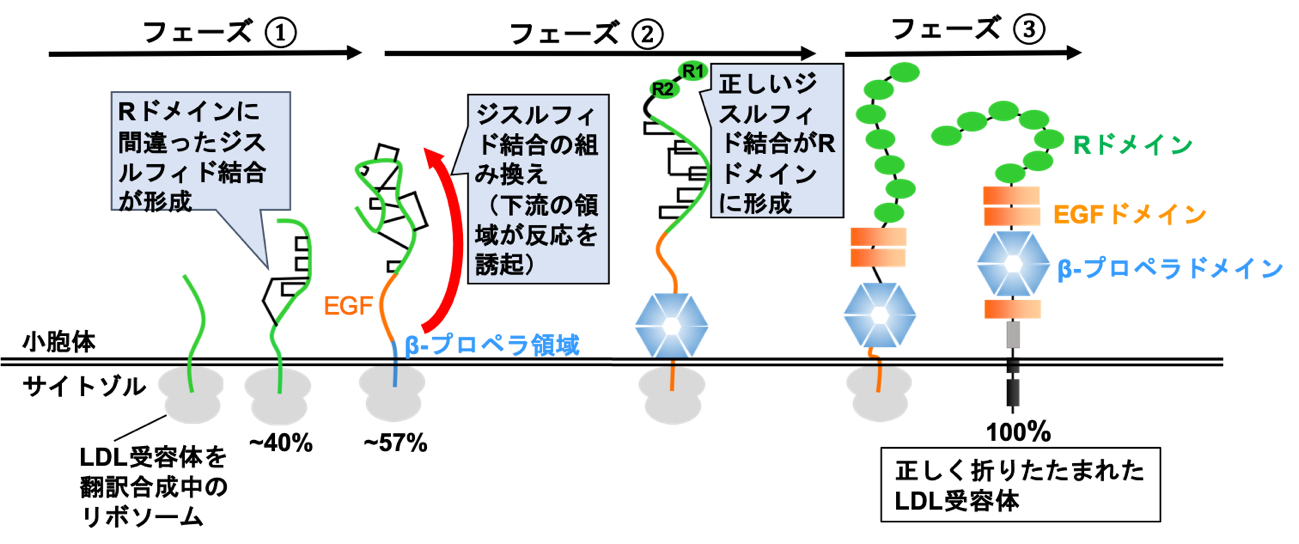
図1 LDL受容体の立体構造形成に関する新しいモデル
数字は、全長を100%とした場合の、合成されたLDL受容体の相対的な長さを表す。その他、詳しくは本文参照。
【用語説明】
注1)ドメイン
タンパク質のドメインは、タンパク質の構造の一部で他の部分とは独立した機能を持つ。タンパク質を構成する各ドメインは、コンパクトな三次元構造を作り、独立に折り畳まれ、安定化される。
注2)PDIファミリータンパク質
小胞体中に存在し、ジスルフィド結合の形成、組み換え、開裂を行う酵素群。ヒト細胞の小胞体中には20種類以上のPDIファミリータンパク質が存在する。
【論文情報】
タイトル:Observing the nonvectorial yet cotranslational folding of a multidomain protein, LDL receptor, in the ER of mammalian cells
著者:Hiroshi Kadokura1,2,3,*, Yui Dazai2, Yo Fukuda2, Naoya Hirai1, Orie Nakamura1, Kenji Inaba1,2,3
所属:1東北大学 多元物質科学研究所、2東北大学大学院 生命科学研究科、 3東北大学大学院 理学研究科化学専攻
掲載誌:Proceedings of the National Academy of Sciences of the United States of America (Proc. Natl. Acad. Sci. USA)
【問い合わせ先】
(研究に関すること)
東北大学多元物質科学研究所
担当:准教授 門倉 広(かどくら ひろし)
電話:022-217-5605
E-mail:hiroshi.kadokura.b3(at)tohoku.ac.jp
(報道に関すること)
東北大学多元物質科学研究所
広報情報室
電話: 022-217-5198
E-mail:press.tagen(at)grp.tohoku.ac.jp

