慶應義塾大学理工学部応用化学科の高橋大介准教授、戸嶋一敦教授、東北大学大学院生命科学研究科の横山武司助教、微生物化学研究所の五十嵐雅之博士らの研究グループは、マクロライド系抗生物質(※1)アジスロマイシン(AZM)に対する新規化学修飾法の開発を行い、本手法を駆使することで肺非結核性抗酸菌(NTM)症に対する新規リード化合物の創出に成功しました。
NTMの肺への感染により引き起こされる肺NTM症に対する治療には、AZMが広く利用されていますが、薬剤耐性菌の出現により、新規治療薬の開発が強く求められていました。そこで本研究では、独自に開発してきた位置及び立体選択的グリコシル化反応(※2)を用いて、新規AZM誘導体を迅速に合成する合成法の確立とライブラリーの合成を達成しました。さらに、合成したライブラリーの NTM に対する抗菌活性を評価した結果、誘導体KU13が、薬剤感受性及び薬剤耐性NTMに対してAZMよりも高い抗菌活性を発現することを見出し、本誘導体が新規肺NTM症治療薬候補であることを明らかにしました。また、本誘導体の作用機序解析を行った結果、本誘導体が標的分子であるリボソーム(※3)の構造変化を誘導しながら新しい相互作用を形成する、ユニークな作用機序を明らかにしました。この発見は、薬剤耐性NTMに有効な新たな肺NTM症治療薬の開発への寄与が期待されます。
本研究の成果は、2025年3月5日に、アメリカの総合科学雑誌「Science Advances(サイエンス アドバンシス)」で公開されました。
NTMの肺への感染により引き起こされる肺NTM症に対する治療には、AZMが広く利用されていますが、薬剤耐性菌の出現により、新規治療薬の開発が強く求められていました。そこで本研究では、独自に開発してきた位置及び立体選択的グリコシル化反応(※2)を用いて、新規AZM誘導体を迅速に合成する合成法の確立とライブラリーの合成を達成しました。さらに、合成したライブラリーの NTM に対する抗菌活性を評価した結果、誘導体KU13が、薬剤感受性及び薬剤耐性NTMに対してAZMよりも高い抗菌活性を発現することを見出し、本誘導体が新規肺NTM症治療薬候補であることを明らかにしました。また、本誘導体の作用機序解析を行った結果、本誘導体が標的分子であるリボソーム(※3)の構造変化を誘導しながら新しい相互作用を形成する、ユニークな作用機序を明らかにしました。この発見は、薬剤耐性NTMに有効な新たな肺NTM症治療薬の開発への寄与が期待されます。
本研究の成果は、2025年3月5日に、アメリカの総合科学雑誌「Science Advances(サイエンス アドバンシス)」で公開されました。
1. 本研究のポイント
- マクロライド系抗生物質AZMに対する位置及び立体選択的グリコシル化反応により、効率的に新規AZM誘導体ライブラリーの合成を達成しました。
- ライブラリーの抗菌活性評価を行った結果、新規AZM誘導体KU13が、薬剤感受性NTMだけでなく、薬剤耐性NTMに対しても、AZMよりも高い抗菌活性を発現することを明らかにしました。
- KU13が、細菌のタンパク質合成のプラットフォームであるリボソームを標的として機能することを明らかにしました。試験管内でタンパク質合成を再構成した「無細胞翻訳系」を用いた解析で、AZMより、強い活性を示すことが明らかになりました。
- クライオ電子顕微鏡(※4)を用いた構造解析により、結核菌リボソームのペプチドトンネル内にKU13が結合する様子の可視化しました。KU13の結合により、リボソームの構成要素である、リボソームRNAの2847番目のウラシル(U2847)塩基を回転させ、自らの結合サイトを創出する新しい機構が明らかとなりました。
2. 研究背景
NTMの肺への感染により引き起こされる肺NTM症は、慢性的な呼吸器感染症であり、長期の治療期間を必要とし、再発も高確率で生じること、肺に病気がなく免疫力が正常な人も感染すること、さらに世界中で罹患率が上昇していることから解決すべき喫緊の課題です。
現在、肺NTM症に対する代表的な治療には、マクロライド系抗生物質であるAZMが広く利用されています。AZMは、標的分子であるリボソームの機能を阻害する事により抗菌活性を発現します。抗菌薬の主な標的であるリボソームに変異が生じ、AZMに対する耐性を獲得した薬剤耐性NTMの出現により、薬剤耐性NTMにも有効な新規肺NTM症治療薬の創出が急務となっています。また、NTM以外でも既存の抗菌薬が効かなくなる薬剤耐性菌の蔓延は国際社会でも問題視されており、薬剤耐性菌に対して有効な活性を示す新規抗菌薬を迅速に合成する効率的な化学修飾法の開発が強く求められてきました。
現在、肺NTM症に対する代表的な治療には、マクロライド系抗生物質であるAZMが広く利用されています。AZMは、標的分子であるリボソームの機能を阻害する事により抗菌活性を発現します。抗菌薬の主な標的であるリボソームに変異が生じ、AZMに対する耐性を獲得した薬剤耐性NTMの出現により、薬剤耐性NTMにも有効な新規肺NTM症治療薬の創出が急務となっています。また、NTM以外でも既存の抗菌薬が効かなくなる薬剤耐性菌の蔓延は国際社会でも問題視されており、薬剤耐性菌に対して有効な活性を示す新規抗菌薬を迅速に合成する効率的な化学修飾法の開発が強く求められてきました。
3. 研究内容・成果
今回、本研究グループは、独自に開発してきた位置及び立体選択的グリコシル化反応[1]を用いて、AZMに対する新規化学修飾法を開発しました。本手法の特長は、1,2-アンヒドロ糖およびボロン酸触媒を用いることで、AZMに対して完全な立体選択性及び11位選択性で糖修飾を行うことができ、非常に効率的である点です。本手法を駆使して、AZMを11位選択的に化学修飾した新規AZM誘導体ライブラリーの迅速な合成を達成しました。さらに、合成した新規AZM誘導体ライブラリーの薬剤感受性NTM及び薬剤耐性NTMに対する抗菌活性を微量液体希釈法により評価した結果、AZM誘導体KU13(図1, 特願2023-90620)が、いずれのNTMに対しても、AZMよりも高い抗菌活性を発現することを明らかにし、有望な新規リード化合物の創製に成功しました。
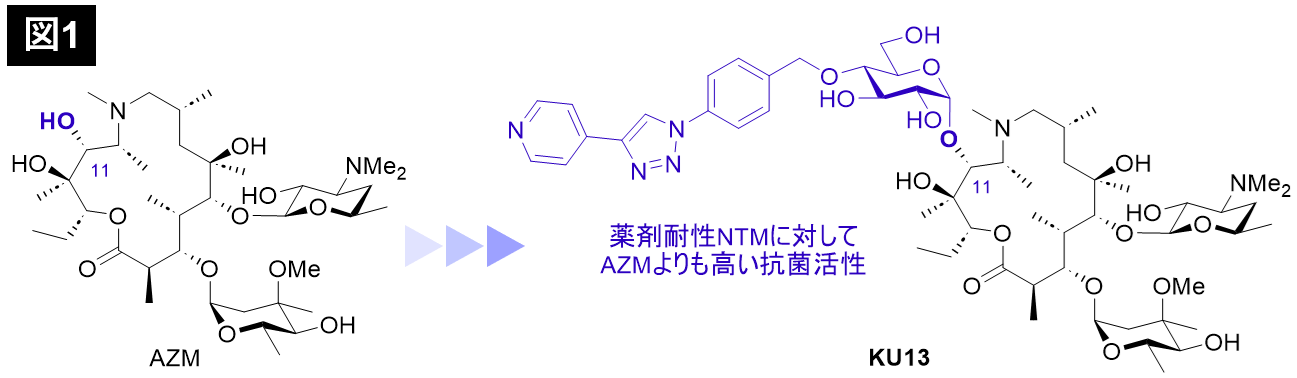
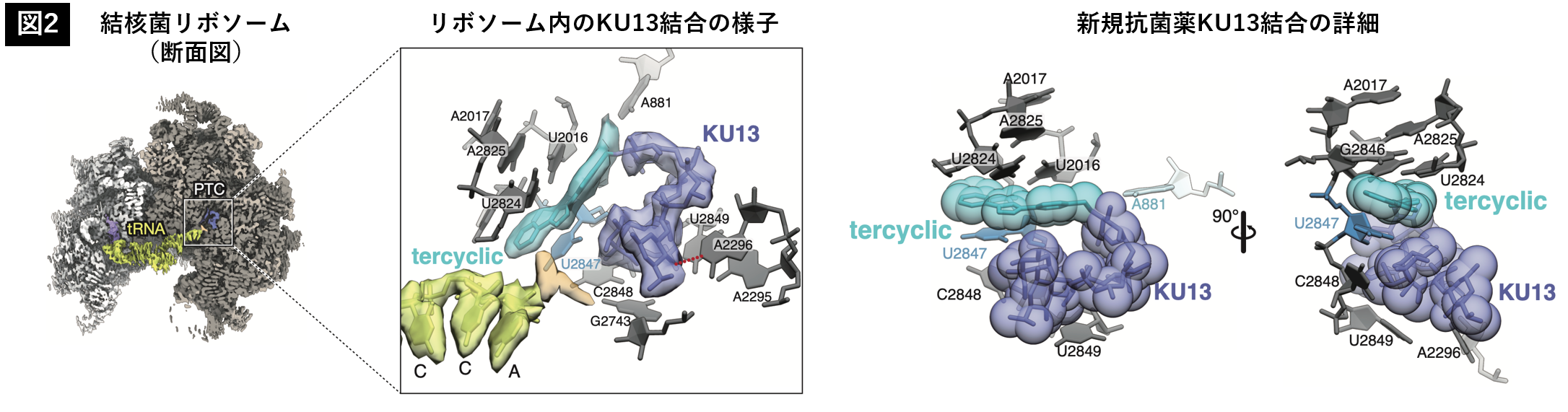
さらに本研究では、KU13の作用機序解析を行いました。まず、KU13がリボソームの機能を阻害するのかを検証しました。試験管内に、翻訳過程に必要なすべての要素を再構成した「無細胞翻訳系」を用いて、様々な抗菌薬濃度存在下で、リボソームによるタンパク質合成がどの程度阻害されるのかを確認しました。その結果、AZMと比較して、KU13はより強い翻訳阻害活性を発揮することが明らかになりました。次に、KU13がリボソームに結合する様子をクライオ電子顕微鏡により可視化しました。本研究では、KU13の標的である代表的な抗酸菌として結核菌を用いて、リボソームを精製し、そこにKU13を添加して構造解析を行いました。構造解析には、東北大学未来型医療創成センター(INGEM)に導入されている、透過型電子顕微鏡 CRYO ARM 300 IIを使用しました。その結果、KU13がリボソームの内部、合成されたタンパク質が通り抜けるトンネル内に結合する様子が明らかになりました(図2)。さらに興味深いことに、KU13は結合の際、リボソームを構成するRNAである、2847番目のウラシル(U2847)の塩基を、回転させ、自らの結合サイトを創出する、新しいメカニズムで結合する様子が明らかになりました。
4.今後の展開
独自に開発してきた位置及び立体選択的グリコシル化反応を駆使することにより、AZMの11位選択的な化学修飾法の開発に成功しました。さらに、本手法を駆使して合成した新規AZM誘導体KU13が、薬剤耐性NTMに対してAZMよりも高い抗菌活性を発現する有望な新規リード化合物であることを明らかにしました。さらに、クライオ電子顕微鏡を用いた構造解析により、KU13の作用機序の解明に成功しました。今後、本化学修飾法を駆使した新たな肺NTM症治療薬の開発が期待されます。
独自に開発してきた位置及び立体選択的グリコシル化反応を駆使することにより、AZMの11位選択的な化学修飾法の開発に成功しました。さらに、本手法を駆使して合成した新規AZM誘導体KU13が、薬剤耐性NTMに対してAZMよりも高い抗菌活性を発現する有望な新規リード化合物であることを明らかにしました。さらに、クライオ電子顕微鏡を用いた構造解析により、KU13の作用機序の解明に成功しました。今後、本化学修飾法を駆使した新たな肺NTM症治療薬の開発が期待されます。
5.付記
本研究は、日本学術振興会(JSPS)科学研究費補助金(課題番号: 23H01966)、国立研究開発法人科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「新たな生産プロセス構築のための電子やイオン等の能動的制御による革新的反応技術の創出」研究領域研究課題名「「ルイス酸—外部刺激」系によるイオン性中間体の活性化」(課題番号: JPMJCR20R3)、国立研究開発法人日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)「広域スペクトルを有する抗ウイルス薬開発を目指した創薬標的探索と次世代創薬モダリティの基盤構築」(課題番号: JP22gm1610010)、科学技術振興機構(JST)戦略的創造研究推進事業、さきがけ細胞の動的高次構造体「リボソームの動的分子構造と細胞内分布の統合的理解(課題番号: JPMJPR20EG)、国立研究開発法人科学技術振興機構(JST)次世代研究者挑戦的プログラム(SPRING)(課題番号: JPMJSP2123)、及び公益財団法人シオノギ感染症研究振興財団 (創薬研究助成金)などの支援を受けて行われました。また、クライオ電子顕微鏡測定は、東北大学未来型医療創成センター(INGEM)(AMED研究助成金JP20am0101095)のクライオ電子顕微鏡施設を利用しました。
本研究は、日本学術振興会(JSPS)科学研究費補助金(課題番号: 23H01966)、国立研究開発法人科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「新たな生産プロセス構築のための電子やイオン等の能動的制御による革新的反応技術の創出」研究領域研究課題名「「ルイス酸—外部刺激」系によるイオン性中間体の活性化」(課題番号: JPMJCR20R3)、国立研究開発法人日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)「広域スペクトルを有する抗ウイルス薬開発を目指した創薬標的探索と次世代創薬モダリティの基盤構築」(課題番号: JP22gm1610010)、科学技術振興機構(JST)戦略的創造研究推進事業、さきがけ細胞の動的高次構造体「リボソームの動的分子構造と細胞内分布の統合的理解(課題番号: JPMJPR20EG)、国立研究開発法人科学技術振興機構(JST)次世代研究者挑戦的プログラム(SPRING)(課題番号: JPMJSP2123)、及び公益財団法人シオノギ感染症研究振興財団 (創薬研究助成金)などの支援を受けて行われました。また、クライオ電子顕微鏡測定は、東北大学未来型医療創成センター(INGEM)(AMED研究助成金JP20am0101095)のクライオ電子顕微鏡施設を利用しました。
【用語説明】
※1 マクロライド系抗生物質
多員環ラクトンに糖が結合した抗生物質の総称。細菌のタンパク質合成を阻害することで抗菌作用を発現する。
多員環ラクトンに糖が結合した抗生物質の総称。細菌のタンパク質合成を阻害することで抗菌作用を発現する。
※2 グリコシル化反応
ある化合物に対して糖を付加する重要な素反応。
ある化合物に対して糖を付加する重要な素反応。
※3 リボソーム
遺伝子にコードされた遺伝情報を読み取り、アミノ酸で構成されたタンパク質を合成する、細胞内のタンパク質合成工場。生命の根幹である、セントラルドグマを担うことから生命維持において必須の複合体である。タンパク質合成のプラットフォームの役割を担うのが、RNAとタンパク質で構成される巨大な超分子複合体リボソームである。2000年代初頭にX線結晶構造解析によりその構造の全貌が明らかにされ、結晶化により高分解能構造解析に成功した3名の研究者に2009年にノーベル化学賞が与えられた。抗菌薬の主な標的として知られる。
遺伝子にコードされた遺伝情報を読み取り、アミノ酸で構成されたタンパク質を合成する、細胞内のタンパク質合成工場。生命の根幹である、セントラルドグマを担うことから生命維持において必須の複合体である。タンパク質合成のプラットフォームの役割を担うのが、RNAとタンパク質で構成される巨大な超分子複合体リボソームである。2000年代初頭にX線結晶構造解析によりその構造の全貌が明らかにされ、結晶化により高分解能構造解析に成功した3名の研究者に2009年にノーベル化学賞が与えられた。抗菌薬の主な標的として知られる。
※4 クライオ電子顕微鏡
タンパク質などの生体試料を急速凍結し、ガラス状の氷に閉じ込め、透過型電子顕微鏡で直接観察する技術。画像処理と組み合わせることで、高分解能立体構造の再構成が可能で、タンパク質の「かたち」を知るための手法である。2017年に初期の技術開発に貢献した3名の研究者にノーベル化学賞が与えられた。
タンパク質などの生体試料を急速凍結し、ガラス状の氷に閉じ込め、透過型電子顕微鏡で直接観察する技術。画像処理と組み合わせることで、高分解能立体構造の再構成が可能で、タンパク質の「かたち」を知るための手法である。2017年に初期の技術開発に貢献した3名の研究者にノーベル化学賞が与えられた。
<参考文献>
[1] 総説: ホウ素媒介アグリコン転移反応の新展開:反応開発, 有用糖質合成, およびケミカルバイオロジーへの応用, 高橋大介, 戸嶋一敦, 有機合成化学協会誌, 2024, 82, 856-866., doi: 10.5059/yukigoseikyokaishi.82.856.
[2] Review: Boron-mediated aglycon delivery (BMAD) for the stereoselective synthesis of 1,2-cis glycosides, Takahashi, D.; Toshima, K. Adv. Carbohydr. Chem. Biochem., 2022, 82, 79-105., doi: 10.1016/bs.accb.2022.10.003.
[1] 総説: ホウ素媒介アグリコン転移反応の新展開:反応開発, 有用糖質合成, およびケミカルバイオロジーへの応用, 高橋大介, 戸嶋一敦, 有機合成化学協会誌, 2024, 82, 856-866., doi: 10.5059/yukigoseikyokaishi.82.856.
[2] Review: Boron-mediated aglycon delivery (BMAD) for the stereoselective synthesis of 1,2-cis glycosides, Takahashi, D.; Toshima, K. Adv. Carbohydr. Chem. Biochem., 2022, 82, 79-105., doi: 10.1016/bs.accb.2022.10.003.
【論文情報】
Creation of a Macrolide Antibiotic against Non-tuberculous Mycobacterium Using Late-stage Boron-mediated Aglycon Delivery, Yuka Isozaki, Takumi Makikawa, Kosuke Kimura, Daiki Nishihara, Maho Fujino, Yoshikazu Tanaka, Chigusa Hayashi, Yoshimasa Ishizaki, Masayuki Igarashi, Takeshi Yokoyama, Kazunobu Toshima and Daisuke Takahashi, Science Advances, 2025,
doi: 10.1126/sciadv.adt2352.
【関連リンク】
【お問い合わせ先】
(研究に関すること)
東北大学大学院 生命科学研究科
東北大学未来型医療創成センター(INGEM)
助教 横山 武司(よこやま たけし)
TEL:022-217-6206
助教 横山 武司(よこやま たけし)
TEL:022-217-6206
E-mail:takeshi.yokoyama.d1(at)tohoku.ac.jp
(報道に関すること)
東北大学 大学院生命科学研究科 広報室
TEL:022-217-6193
Email:lifsci-pr(at)grp.tohoku.ac.jp
TEL:022-217-6193
Email:lifsci-pr(at)grp.tohoku.ac.jp

東北大学は持続可能な開発目標(SDGs)を支援しています

