発表のポイント
- 細胞中のカルシウムの恒常性維持に重要な小胞体膜局在カルシウムポンプSERCA2bの結晶構造を世界で初めて明らかにした。
- SERCA2bに特徴的な11番目の膜貫通ヘリックスが、他の膜貫通へリックス領域と分子内相互作用することで活性を制御するという、カルシウムポンプの新しい活性制御機構モデルを提唱した。
概要
東北大学多元物質科学研究所の井上道雄助教、渡部聡助教、稲葉謙次教授(生命科学研究科、理学研究科化学専攻 兼担)、および奈良先端科学技術大学院大学の塚崎智也教授、大阪大学の高木淳一教授、東北大学未来科学技術共同研究センター/東北大学大学院医学系研究科の加藤幸成教授、京都産業大学の永田和宏教授らを中心とした共同研究グループは、JST戦略的創造研究推進事業において、筋収縮の制御やアポトーシスの誘導など、様々な生命現象において重要な役割をもつカルシウムイオンの恒常性を保つ上で必須のカルシウムポンプSERCA2bの高分解能構造を世界で初めて明らかにしました。
細胞小器官の一つである小胞体は、細胞内での適切なカルシウムイオン濃度を維持するために、カルシウムを取り込み、蓄える働きがあります。SERCA2bはこのカルシウムの取込みを担い、全組織に広く発現している膜たんぱく質です。骨格筋や心筋に特異的に発現するSERCA1a(SERCA2bのアイソフォーム注1やSERCA2a(SERCA2bのスプライシングバリアント注2とは異なり、SERCA2bには11番目の膜貫通ヘリックス(TM11)を含む特徴的なC末端領域があります。このC末端領域によってSERCA2bの活性が制御されることは過去に報告されていますが、その詳しいメカニズムは分かっていませんでした。
我々は、SERCA2bの立体構造をX線結晶構造解析注3によって決定し、TM11がこれまでの予想とは全く異なる位置に存在することを明らかにしました。TM11は、SERCA2b分子内でL8/9ループとTM10の一部と相互作用することが構造から分かり、アミノ酸の変異体解析によって、これら分子内相互作用がSERCA2bの活性制御に重要であることが明らかとなりました。また、同じ手法で決定したSERCA2aの立体構造と比較したところ、SERCA2bのTM11によって膜貫通へリックス領域の動きが抑えられることが示され、この動きの抑制がSERCA2bの活性を制御することを考察しました。これらの成果によって、SERCA2bの他のカルシウムポンプとは異なる活性制御のメカニズムが原子レベルで明らかとなりました。
本研究成果は、2019年4月23日11時(アメリカ東部時間)に米国科学誌Cell Reportsに掲載されます。
細胞小器官の一つである小胞体は、細胞内での適切なカルシウムイオン濃度を維持するために、カルシウムを取り込み、蓄える働きがあります。SERCA2bはこのカルシウムの取込みを担い、全組織に広く発現している膜たんぱく質です。骨格筋や心筋に特異的に発現するSERCA1a(SERCA2bのアイソフォーム注1やSERCA2a(SERCA2bのスプライシングバリアント注2とは異なり、SERCA2bには11番目の膜貫通ヘリックス(TM11)を含む特徴的なC末端領域があります。このC末端領域によってSERCA2bの活性が制御されることは過去に報告されていますが、その詳しいメカニズムは分かっていませんでした。
我々は、SERCA2bの立体構造をX線結晶構造解析注3によって決定し、TM11がこれまでの予想とは全く異なる位置に存在することを明らかにしました。TM11は、SERCA2b分子内でL8/9ループとTM10の一部と相互作用することが構造から分かり、アミノ酸の変異体解析によって、これら分子内相互作用がSERCA2bの活性制御に重要であることが明らかとなりました。また、同じ手法で決定したSERCA2aの立体構造と比較したところ、SERCA2bのTM11によって膜貫通へリックス領域の動きが抑えられることが示され、この動きの抑制がSERCA2bの活性を制御することを考察しました。これらの成果によって、SERCA2bの他のカルシウムポンプとは異なる活性制御のメカニズムが原子レベルで明らかとなりました。
本研究成果は、2019年4月23日11時(アメリカ東部時間)に米国科学誌Cell Reportsに掲載されます。
研究の背景
小胞体は膜たんぱく質や分泌たんぱく質の生合成やカルシウムの貯蔵を行う細胞内小器官です。小胞体膜局在のATP駆動型カルシウムポンプであるSERCA2bは、細胞質から小胞体内へカルシウムを取り込むことで、カルシウムの制御や細胞内のカルシウム濃度の恒常性維持において重要な役割をもつことが知られています。ハウスキーピングたんぱく質 注4であるSERCA2bは、組織特異的に発現するアイソフォームのSERCA1aやスプライシングバリアントのSERCA2aとは異なり、C末端に11番目の膜貫通へリックス(TM11)が存在します。そのため、SERCA2bだけが、C末端が小胞体内腔側に位置した特徴的な構造を持っています(図1)。このTM11を含むC末端領域によってSERCA2bの活性が制御されることやカルシウムに対する結合能が強まることが報告されていますが、その詳しい機構については分かっていませんでした。
SERCA2bのアイソフォームであるSERCA1aについては、様々な中間状態で構造が決定されていますが、SERCA2bの構造についてはこれまでに報告はありませんでした。そこで、全組織において細胞内のカルシウムイオン恒常性維持に関わるSERCA2bの活性制御メカニズムを原子レベルで理解するため、SERCA2bの構造を決定することを試みました。
SERCA2bのアイソフォームであるSERCA1aについては、様々な中間状態で構造が決定されていますが、SERCA2bの構造についてはこれまでに報告はありませんでした。そこで、全組織において細胞内のカルシウムイオン恒常性維持に関わるSERCA2bの活性制御メカニズムを原子レベルで理解するため、SERCA2bの構造を決定することを試みました。
研究の内容と成果
本研究ではまず、SERCA2bの構造をX線結晶構造解析により明らかにするために、脂質キュービックフェーズ法注5を用いて結晶を作製しました。構造を安定化させるために、カルシウムとATPが結合した状態を模したE1-AMPPCP状態の結晶を用いて、SPring-8 BL32XUにてX線回折実験を行い、SERCA2bの結晶構造を3.45 Å分解能で決定しました。得られた構造から、SERCA2bはAドメイン(駆動ドメイン)、Nドメイン(ATP結合ドメイン)、Pドメイン(リン酸化ドメイン)の三つの細胞質ドメインと、11個の膜貫通ヘリックス(N末端からTM1~TM11と呼ぶ)からなっており、AMPPCPとマグネシウムイオン、二つのカルシウムイオンの位置と結合様式を同定しました(図2)。SERCA2bに特徴的なTM11は、従来の研究で予想されていた位置とは大きく異なり、TM10の横に離れて存在していました。また、TM11の分子内相互作用を調べたところ、TM11がTM8とTM9を結ぶL8/9ループとTM10のN末端と部分的に結合することが示されました(図3)。この相互作用に関わるTM11中のアミノ酸(1018番目のフェニルアラニンと1029番目のバリン)に変異を導入し、それら変異体の活性評価を行ったところ、野生型に比べて活性が大きく上昇することが分かりました。このことから、TM11はL8/9ループとTM10との相互作用によってSERCA2bの活性を制御することが示されました。
同様に、スプライシングバリアントであるSERCA2aについても3.2 Å分解能での結晶構造の決定に成功しました。SERCA2bとSERCA2aの細胞質ドメインの構造を重ね合わせたところ、SERCA2aのTM10がSERCA2bのTM11と立体障害を起こすことが分かりました。この結果から、TM11によって膜貫通へリックス領域(TM1-10)の動きが制限されることが示唆されました。以上の結果から、SERCA2bのTM11が、TM1-10の動きを抑制することで、SERCA2bの活性を制御するという新たなメカニズムを提唱しました(図4)。
同様に、スプライシングバリアントであるSERCA2aについても3.2 Å分解能での結晶構造の決定に成功しました。SERCA2bとSERCA2aの細胞質ドメインの構造を重ね合わせたところ、SERCA2aのTM10がSERCA2bのTM11と立体障害を起こすことが分かりました。この結果から、TM11によって膜貫通へリックス領域(TM1-10)の動きが制限されることが示唆されました。以上の結果から、SERCA2bのTM11が、TM1-10の動きを抑制することで、SERCA2bの活性を制御するという新たなメカニズムを提唱しました(図4)。
今後の展開
本研究成果として、SERCA2bの反応サイクルにおいてカルシウムとATPが結合した状態の構造解析に世界で初めて成功しました。その結果、TM11を介した分子内相互作用による活性制御メカニズムを提唱することができました。今後は、他の複数の中間状態でのSERCA2bの構造解析を行うことで、反応サイクル全体におけるSERCA2bのC末端領域を介した活性制御機構の全容を解明したいと考えています。小胞体へのカルシウムの取り込みの阻害が強い小胞体ストレスを誘導することが知られており、またそのことが神経変性疾患、糖尿病などの疾患を引き起こすことも報告されています。さらに、SERCA2bの遺伝子変異による機能不全が、ダリエ病という皮膚病を引き起こすことも広く知られています。したがって、本研究で得られた知見は、細胞内カルシウムが関わる種々の生命現象の解明のみならず、細胞のカルシウム恒常性維持機構の破綻が引き起こす様々な疾病の原因解明および治療戦略の開発につながることが期待されます。

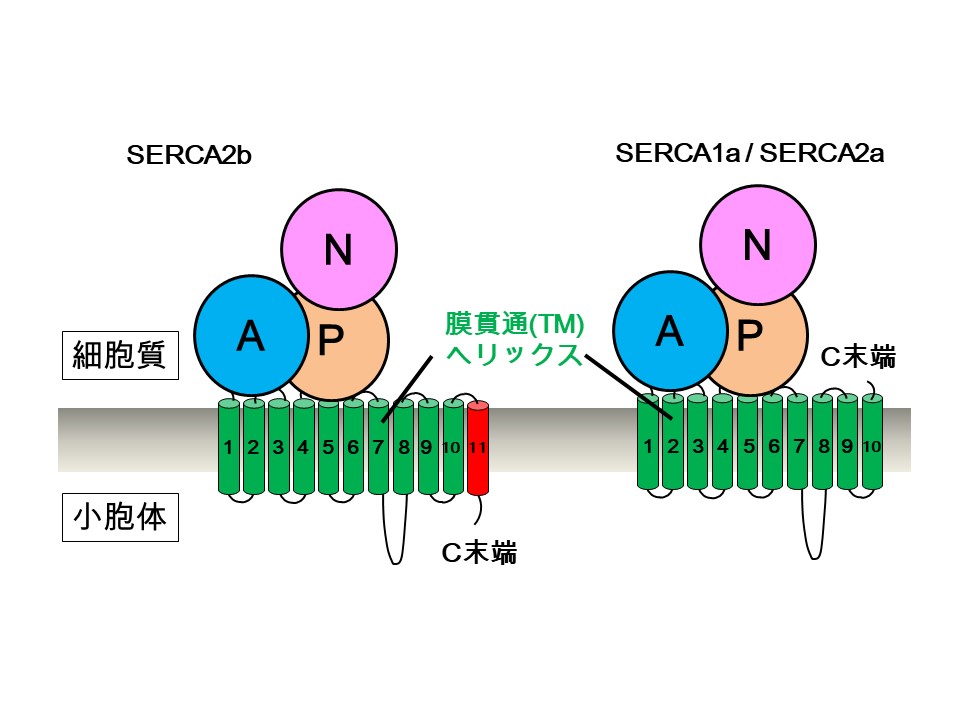
図1 SERCA2bとそのアイソフォームSERCA1a/SERCA2aの簡略図
SERCA2bは11個の膜貫通ヘリックス(TM1~TM11)を有しており、C末端は小胞体内腔側に位置する。一方、アイソフォームのSERCA1aやスプライシングバリアントのSERCA2aは、10個のTMヘリックス(TM1~TM10)を有するため、C末端は細胞質側に存在する。11番目のTMヘリックス(TM11)とそれに続くC末端テール領域が、SERCA2bの活性制御において重要な役割をもつと考えられてきた。

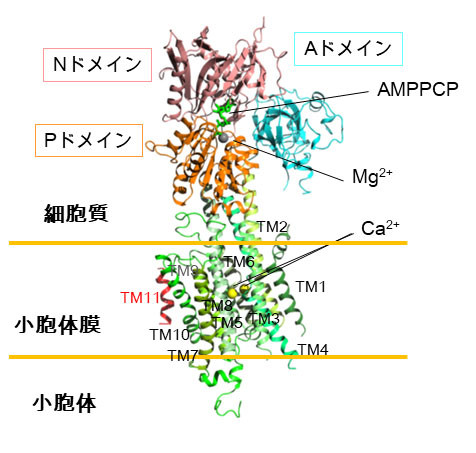
図2 SERCA2bのX線結晶構造
SERCA2bはドメイン間の動きを調節するAドメイン、ヌクレオチド結合ポケットを持つNドメイン、リン酸化部位を含むPドメインの三つの細胞質ドメインと11個の膜貫通ヘリックス(TM1~TM11)で構成される。Nドメインには加水分解されないATPの類似化合物であるAMPPCPが結合し、またその近くにマグネシウムイオンが配位することを明らかにした。また、膜貫通ヘリックス領域にはカルシウムイオンが二つ結合することが明らかとなった。
SERCA2bはドメイン間の動きを調節するAドメイン、ヌクレオチド結合ポケットを持つNドメイン、リン酸化部位を含むPドメインの三つの細胞質ドメインと11個の膜貫通ヘリックス(TM1~TM11)で構成される。Nドメインには加水分解されないATPの類似化合物であるAMPPCPが結合し、またその近くにマグネシウムイオンが配位することを明らかにした。また、膜貫通ヘリックス領域にはカルシウムイオンが二つ結合することが明らかとなった。

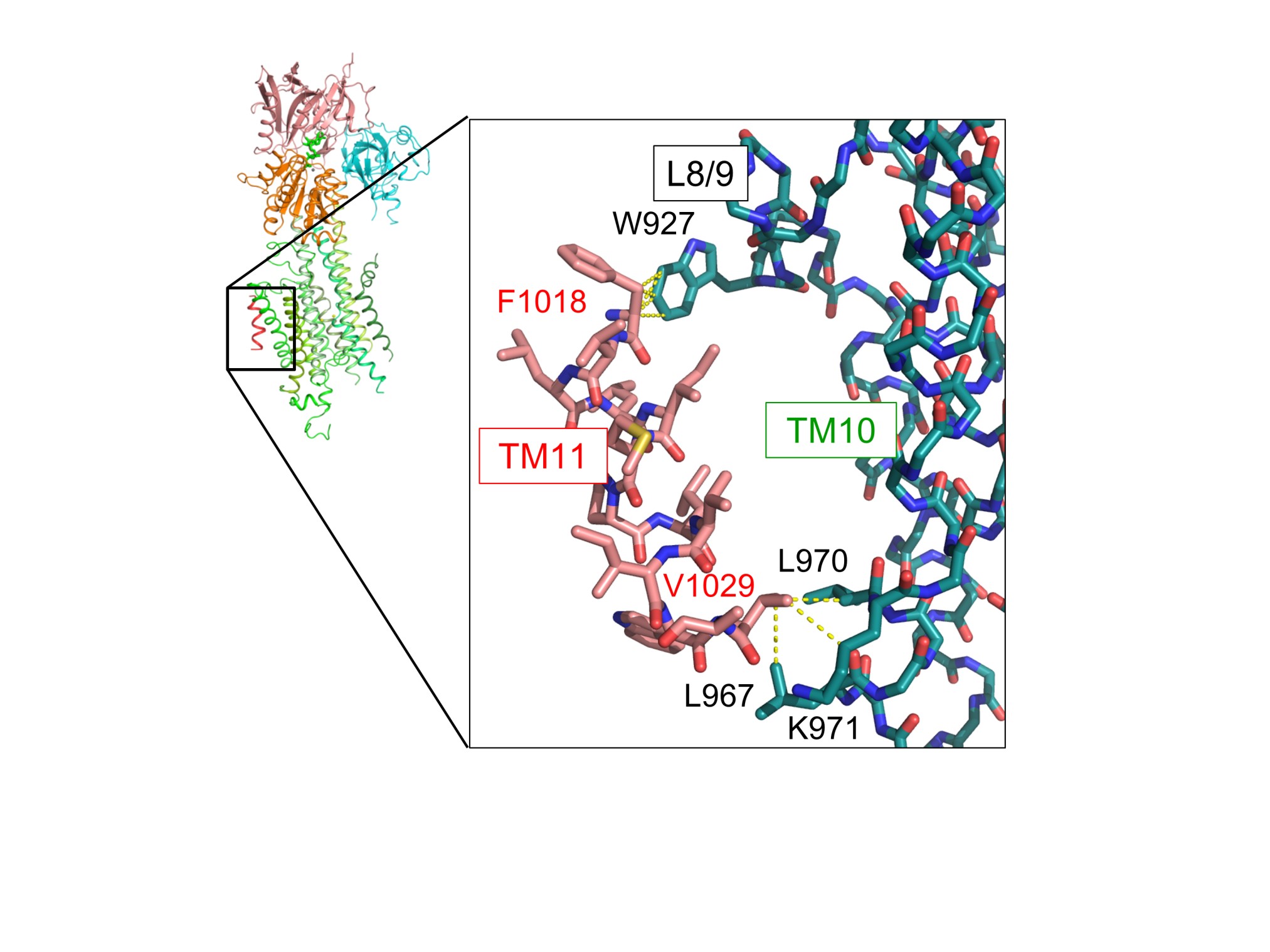
図3 TM11の相互作用様式
TM11周辺において、L8/9ループ中の927番目のトリプトファン(W927)とTM11中の1018番目のフェニルアラニン(F1018)が、TM10中の三つのアミノ酸(L967、L970、K971)とTM11中の1029番目のバリン(V1029)が、それぞれ相互作用することが明らかとなった。黄色の破線は、4 Å以内の距離に位置する原子ペアを表し、それら原子の間で相互作用がはたらくと考察される。
TM11周辺において、L8/9ループ中の927番目のトリプトファン(W927)とTM11中の1018番目のフェニルアラニン(F1018)が、TM10中の三つのアミノ酸(L967、L970、K971)とTM11中の1029番目のバリン(V1029)が、それぞれ相互作用することが明らかとなった。黄色の破線は、4 Å以内の距離に位置する原子ペアを表し、それら原子の間で相互作用がはたらくと考察される。

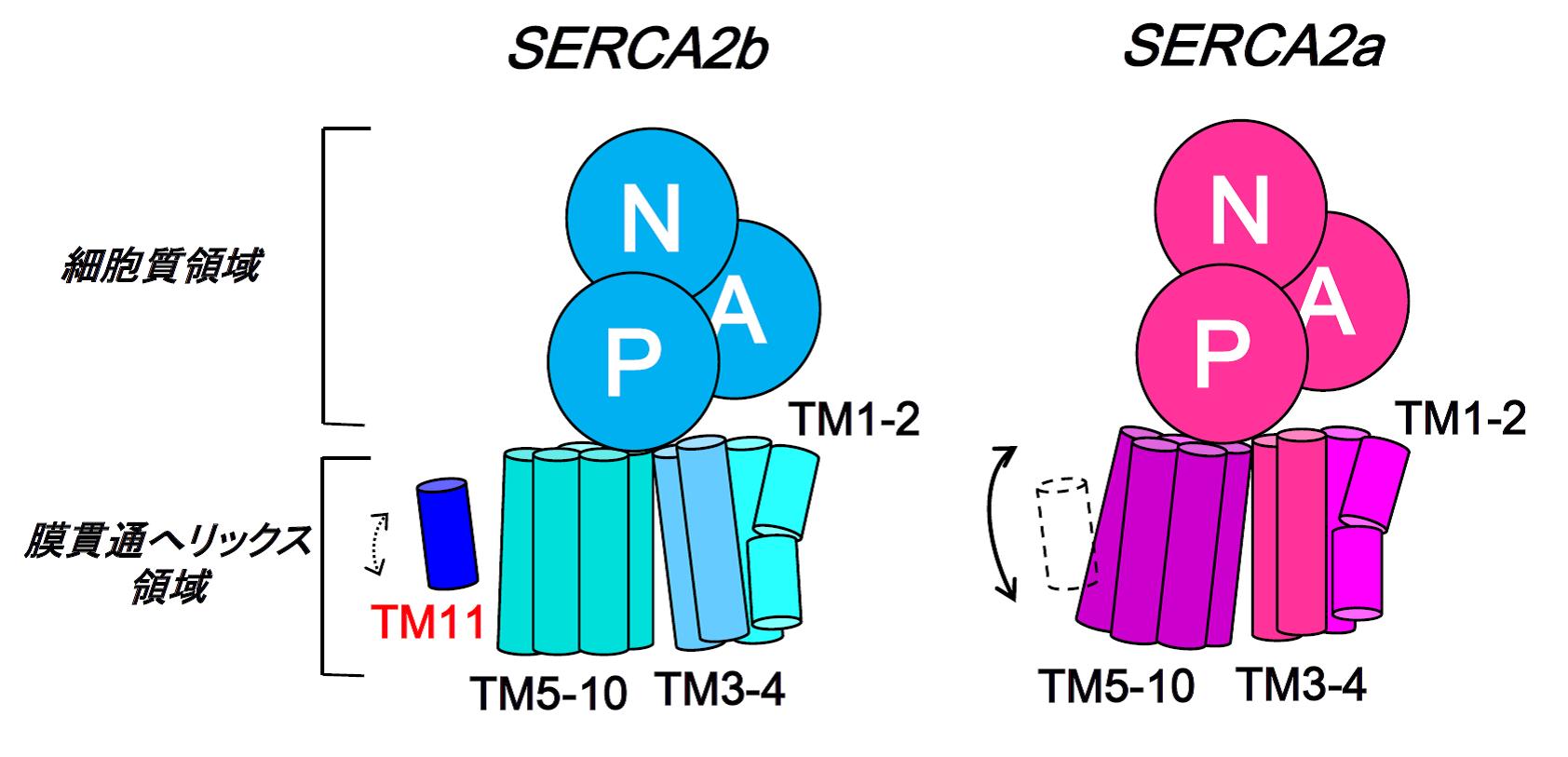
図4 TM11によるSERCA2bの膜貫通へリックス領域の動きの抑制
図3に示したTM11とその周りのアミノ酸間の相互作用のため、さらにはTM11とTM10間の予想される立体障害を避けるため、SERCA2bの膜貫通へリックスの動きはSERCA2aのそれと比べ、抑制されることが明らかとなった。その結果、SERCA2bの活性はSERCA2aよりも低いと考察される。
図3に示したTM11とその周りのアミノ酸間の相互作用のため、さらにはTM11とTM10間の予想される立体障害を避けるため、SERCA2bの膜貫通へリックスの動きはSERCA2aのそれと比べ、抑制されることが明らかとなった。その結果、SERCA2bの活性はSERCA2aよりも低いと考察される。
【用語解説】
注1) 高速原子間力顕微鏡(高速AFM)
基板に固定した分子を、先が極めて細い針で触れながら高速に走査することで、分子の形状と動きを一分子レベルでリアルタイムに観測するナノテクノロジー。
基板に固定した分子を、先が極めて細い針で触れながら高速に走査することで、分子の形状と動きを一分子レベルでリアルタイムに観測するナノテクノロジー。
注2)ジスルフィド結合
近接する2つのシステイン残基のチオール官能基(-SH)が酸化され、硫黄原子間で架橋される共有結合。たんぱく質の立体構造形成を安定化する役割がある。
近接する2つのシステイン残基のチオール官能基(-SH)が酸化され、硫黄原子間で架橋される共有結合。たんぱく質の立体構造形成を安定化する役割がある。
注3)PDIファミリーたんぱく質
ジスルフィド結合の形成、組み換え、開裂を担う小胞体中に存在する酵素群のこと。ヒト細胞の小胞体中では20種類以上のPDIファミリーたんぱく質が存在する。
ジスルフィド結合の形成、組み換え、開裂を担う小胞体中に存在する酵素群のこと。ヒト細胞の小胞体中では20種類以上のPDIファミリーたんぱく質が存在する。
注4)小胞体
細胞内小器官の1つであり、分泌たんぱく質が合成される。この区画で、分泌たんぱく質は酵素依存的に糖鎖修飾やジスルフィド結合形成を受ける。
細胞内小器官の1つであり、分泌たんぱく質が合成される。この区画で、分泌たんぱく質は酵素依存的に糖鎖修飾やジスルフィド結合形成を受ける。
注5)結晶構造
X線結晶構造解析と呼ばれる手法によって決定される分子構造。多くの場合は高分解能であり、原子レベルで分子構造を決定することができる。
X線結晶構造解析と呼ばれる手法によって決定される分子構造。多くの場合は高分解能であり、原子レベルで分子構造を決定することができる。
【論文情報】
著者:Michio Inoue, Nanami Sakuta, Satoshi Watanabe, Yuxia Zhang, Kunihito Yoshikaie, Yoshiki Tanaka, Ryo Ushioda, Yukinari Kato, Junichi Takagi, Tomoya Tsukazaki, Kazuhiro Nagata, Kenji Inaba
タイトル:Structural basis of sarco/endoplasmic reticulum Ca2+-ATPase 2b regulation via transmembrane helix interplay
雑誌名:Cell Reports
DOI:10.1016/j.celrep.2019.03.106
DOI:10.1016/j.celrep.2019.03.106
【問い合わせ先】
<研究に関すること>
稲葉 謙次(イナバ ケンジ)
東北大学 多元物質科学研究所 教授
〒980-8577 宮城県仙台市青葉区片平2丁目1-1
Tel:022-217-5604
E-mail:kinaba(at)tagen.tohoku.ac.jp
東北大学 多元物質科学研究所 教授
〒980-8577 宮城県仙台市青葉区片平2丁目1-1
Tel:022-217-5604
E-mail:kinaba(at)tagen.tohoku.ac.jp
<報道に関すること>
東北大学 多元物質科学研究所 広報情報室
伊藤 智恵(イトウ トモエ)
〒980-8577 宮城県仙台市青葉区片平2丁目1-1
Tel: 022-217-5866
E-mail: soumu(at)tagen.tohoku.ac.jp
伊藤 智恵(イトウ トモエ)
〒980-8577 宮城県仙台市青葉区片平2丁目1-1
Tel: 022-217-5866
E-mail: soumu(at)tagen.tohoku.ac.jp

