発表のポイント
- 翻訳合成途上のタンパク質(新生鎖)へのジスルフィド結合注1導入を検出するシステムを独自に開発した。
- 高速原子間力顕微鏡注2を用いた観察により、PDIファミリー酵素注3が新生ポリペプチド鎖(新生鎖)注4を認識・結合する様子を一分子レベルで可視化することに成功した。
- 代表的な二つのPDIファミリー酵素であるPDIとERp46間で、新生鎖に作用する機構、タイミング、効率が異なることを発見し、両酵素の機能の違いが明らかとなった。
概要
タンパク質の合成や折りたたみがうまくできなくなると、神経変性疾患や糖尿病などの原因となることが知られていますが、合成途上のタンパク質が「正しい」立体構造を形成するしくみについての理解は進んでいませんでした。東北大学多元物質科学研究所の平山千尋博士課程学生、稲葉謙次教授(生命科学研究科、理学研究科化学専攻 兼担)、東北大学学際科学フロンティア研究所の奥村正樹助教、兵庫県立大学大学院工学研究科の今高寛晃教授、町田幸大准教授、大阪大学ナノサイエンスデザイン教育研究センターの野井健太郎特任助教(常勤)、および熊本大学大学院生命科学研究部の小椋光特任教授(研究当時:熊本大学発生医学研究所教授)らを中心とした共同研究グループは、リボソーム注5による新生ポリペプチド鎖(新生鎖)の翻訳合成中にPDI (Protein Disulfide Isomerase) ファミリー酵素であるPDIとERp46が作用する様子を、独自に開発した検出システムおよび高速原子間力顕微鏡を用いて、世界で初めて観察することに成功しました。これにより、細胞内タンパク質恒常性維持に関する重要な知見が得られました。 本成果は、2021年3月9日、米国科学誌iScienceにオンライン掲載されました。
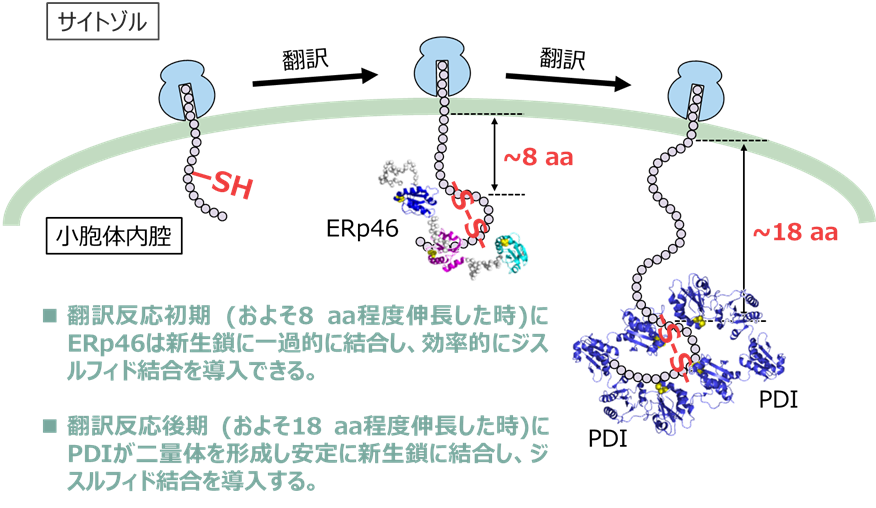
図:新生鎖に作用するPDIとERp46の異なる作用機序 ERp46は新生鎖の翻訳反応初期に一過的に結合し、効率よくジスルフィド結合を導入する。一方、PDIは二量体を形成し、翻訳合成後期に中央の溝に新生鎖を安定に取り込むことで、ジスルフィド結合を導入する。
【用語説明】
注1)ジスルフィド結合
タンパク質中の2つのシステイン残基が2電子酸化を受けることによって形成される、硫黄原子間の共有結合。タンパク質立体構造の形成、安定化に寄与する。
注2)高速原子間力顕微鏡
基板に固定した分子を、針でタップしながら高速に走査することで、分子の形状と動きを一分子レベルでリアルタイムに可視化することが可能なナノテクノロジー。
注3)PDIファミリー酵素 ジスルフィド結合の形成、組み換え、開裂を触媒する小胞体中に存在する酵素群のこと。哺乳動物細胞の小胞体内腔では、20種類以上ものPDIファミリー酵素が存在する。
注4)新生ポリペプチド鎖(新生鎖) リボソームによって合成途上の、アミノ酸が連なった新生タンパク質。
注5)リボソーム 細胞内でmRNAに刻まれた塩基配列情報をもとにタンパク質の合成を行う、RNAとタンパク質からなる超分子複合体。
【発表論文】
著者:Hirayama, C., Machida, K., Noi, K., Murakawa, T., Okumura, M., Ogura, T., Imataka, H. and Inaba, K.*
タイトル:Distinct roles and actions of protein disulfide isomerase family enzymes in catalysis of nascent-chain disulfide bond formation
雑誌名:iScience
【関連リンク】
【お問い合わせ先】
(研究に関すること)
東北大学 多元物質科学研究所
教授 稲葉 謙次(いなば けんじ)
Tel: 022-217-5604
E-mail: kenji.inaba.a1(at)tohoku.ac.jp
(報道に関すること)
東北大学 多元物質科学研究所 広報情報室
伊藤 智恵(いとう ともえ)
Tel: 022-217-5198
E-mail: press.tagen(at)grp.tohoku.ac.jp

