発表のポイント
- 細胞内に取り込まれた物質は、初期エンドソーム、後期エンドソームを経て、最終的にリソソームで分解(この一連のプロセスがエンドソーム成熟*1)
- エンドソーム成熟を制御する新規因子としてTBC1D18を同定し、その制御機構を解明
- 高等動物における、TBC1D18を含めたエンドソーム成熟の新モデルを提唱
概要
細胞膜が内側に陥入してくびり取られると、細胞膜上の分子や細胞外の物質(栄養因子など)を取り込んだ初期エンドソームが形成されます。形成された初期エンドソームは、徐々に内側(内腔)の環境を変化させながら後期エンドソームへと成熟していき、最終的にリソソームとなって取り込んだ物質の分解が行われます。この過程の制御には、酵母などのモデル生物を用いた解析から、進化的に保存された一群のタンパク質(低分子量Gタンパク質Rab5やRab7*2など)の関与が報告されていましたが、高等動物に特有な機構が存在するのかなど、その詳細は明らかではありませんでした。
東北大学大学院生命科学研究科の平城柊博士大学院生、松井貴英助教、福田光則教授らの研究グループは、エンドソーム成熟を制御する新たなタンパク質としてTBC1D18を発見しました。TBC1D18は初期エンドソーム上のRab5を不活性化することで、エンドソーム成熟を円滑に促進する役割を担うため、TBC1D18を欠損した細胞ではエンドソーム成熟や細胞内に取り込んだ物質の分解が著しく阻害されることを見出しました、本研究によって、これまで提唱されていたモデルに新たな因子を加えることで、高等動物におけるエンドソーム成熟の詳細な分子機構が明らかとなりました。
本研究成果は、2022年10月5日付けで、アメリカの国際科学誌「Journal of Cell Biology」の電子版に掲載されました。
詳細な説明
【背景】
細胞が生きていくためには、細胞外にある栄養素やシグナル因子を、適切に細胞内へと取り込む必要があります。これらの外来因子を取り込むため、細胞はエンドサイトーシス経路*1と呼ばれる特殊な輸送システムを備えています。具体的には、細胞膜を内側に陥入させることで小胞を形成し、その小胞に外来因子を包み込んで細胞内へと取り込みます。この時できる小胞は初期エンドソームと呼ばれ、細胞内でその膜脂質や内腔環境を変化させながら、後期エンドソームへと成熟し、最終的にリソソームとなって取り込んだ物質の分解が行われます(図1)。その後、分解された物質は再利用され、細胞の生存や増殖に役立てられます。
これまでの酵母などのモデル生物を用いた研究から、エンドソーム成熟の分子機構は、低分子量Gタンパク質Rab(ONとOFFの状態をサイクルする分子スイッチ)を中心としたRab5 → Mon1-Ccz1複合体*3 → Rab7というカスケードによって制御されることがわかっています。すなわち、初期エンドソームに局在する活性化したONの状態(GTP結合型)のRab5は、Mon1-Ccz1複合体をリクルートし、この複合体がRab7をONの活性化状態にして後期エンドソームへと成熟させます(図1)。この成熟の過程で、役割を終えたRab5は不活性化され、OFFの状態(GDP結合型)に戻ると考えられますが、不活性化の必要性やその分子機構はこれまで全くわかっていませんでした。
【研究成果】
今回研究グループでは、哺乳動物細胞でRab7の活性化に関わるMon1欠損細胞を樹立し、エンドソーム成熟や物質分解に対する影響を検討しました。その結果、Mon1欠損細胞では野生型の細胞やRab7欠損細胞に比べ、異常に肥大化したリソソームが観察され(図2A)、物質分解能も著しく低下していました。Rab7欠損細胞よりもMon1欠損細胞の方が、エンドソーム成熟障害が重篤であることから、Mon1は単なるRab7の活性化因子ではないと推測されます。その原因を探究したところ、Rab5の過剰な活性化がMon1欠損細胞で起こっていることが明らかになりました。本研究ではさらに、このRab5の過剰な活性化を抑える因子として、高等動物に特有なTBC1D18という機能未知の分子(図2B)の同定に成功しました。このTBC1D18をMon1欠損細胞に発現させると、異常に膨らんだリソソームが元の大きさまで回復しました(図2C)。
TBC1D18の生化学的な性質を詳細に解析した結果、TBC1D18はエンドソーム成熟過程でRab5の不活性化因子として働くことを突き止めました(図3)。また、TBC1D18はMon1と間接的に相互作用することも明らかとなり、これらの分子が協調的にエンドソーム成熟を制御していることが明らかになりました。本研究成果により、従来のエンドソーム成熟のモデルに、TBC1D18を加えた新たなモデルの提唱に成功しています(図4)。エンドソーム成熟は全ての真核細胞で保存されたプロセスであることから、今回の発見は、基礎生物学、特に分子細胞生物学の分野で意義深いものと言えます。エンドソーム成熟機構の破綻は種々のヒトの疾患とも密接に関連することから、今後TBC1D18の機能障害と疾患との関連性が明らかにされることが期待されます。
【用語説明】
*1 エンドサイトーシス経路とエンドソーム成熟
エンドサイトーシスにより細胞膜が陥入して形成される初期エンドソームがリソソームへと成熟し、内容物が分解される経路。初期エンドソームは、その膜の脂質や内腔の環境を変化させながら後期エンドソームへと成熟した後、分解を担うオルガネラであるリソソームと合流し、取り込んだ物質の分解が行われる。この初期エンドソーム、後期エンドソーム、リソソームへの一連の流れを「エンドソーム成熟」と呼ぶ。
*2 低分子量Gタンパク質Rab(ラブ)
分子量20~30kDa程度のタンパク質で、GTPが結合した活性化型(ON)とGDPが結合した不活性化型(OFF)をサイクルする分子スイッチとして機能する。Rabの活性化型への変換にはMon1-Ccz1のような活性化因子が、またRabの不活性化(GTPの加水分解の促進)にはTBC1D18のような不活性化因子が関与する。Rabは細胞内の膜輸送を広く制御し、哺乳類では約60種類の異なる分子が存在する。エンドソーム成熟経路には、Rab5とRab7が関わっており、それぞれ初期エンドソームと後期エンドソームの膜に局在して機能する。
*3 Mon1-Ccz1複合体
Mon1とCcz1の2つのタンパク質から成る複合体。初期エンドソーム上で活性化したRab5によって初期エンドソームへとリクルートされ、Rab7の活性化を行うことで後期エンドソームへの成熟を促す。本研究により、Mon1-Ccz1複合体は単なるRab7の活性化因子ではなく、Rab5の不活性化因子であるTBC1D18のエンドソームへのリクルートにも関与することが明らかになった。
【図】
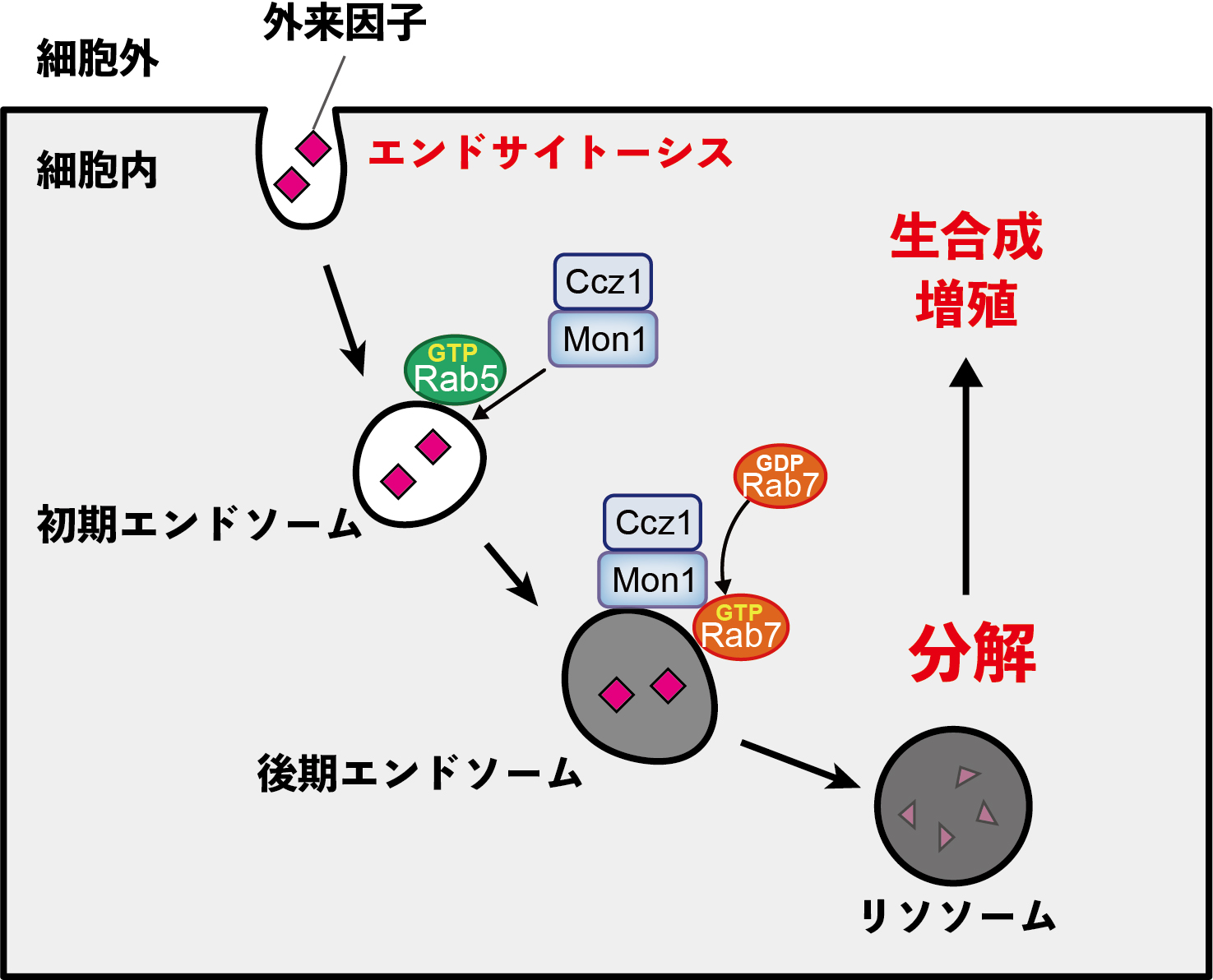
図1 エンドサイトーシス経路とエンドソーム成熟
外来因子や細胞膜上の分子は、エンドサイトーシス(細胞膜が内側に陥入してくびり取られる現象)によって細胞内に取り込まれ、まずRab5が局在する初期エンドソームが形成される。その後、初期エンドソームはRab7が局在する後期エンドソームへと成熟し、最終的にリソソームで取り込んだ物質が分解される。分解された物質は細胞の生合成や増殖のエネルギーに利用される。細胞膜から物質を取り込んでリソソームで分解するまでの経路を「エンドサイトーシス経路」、初期エンドソーム → 後期エンドソーム → リソソームへの一連の変化を「エンドソーム成熟」と呼ぶ。
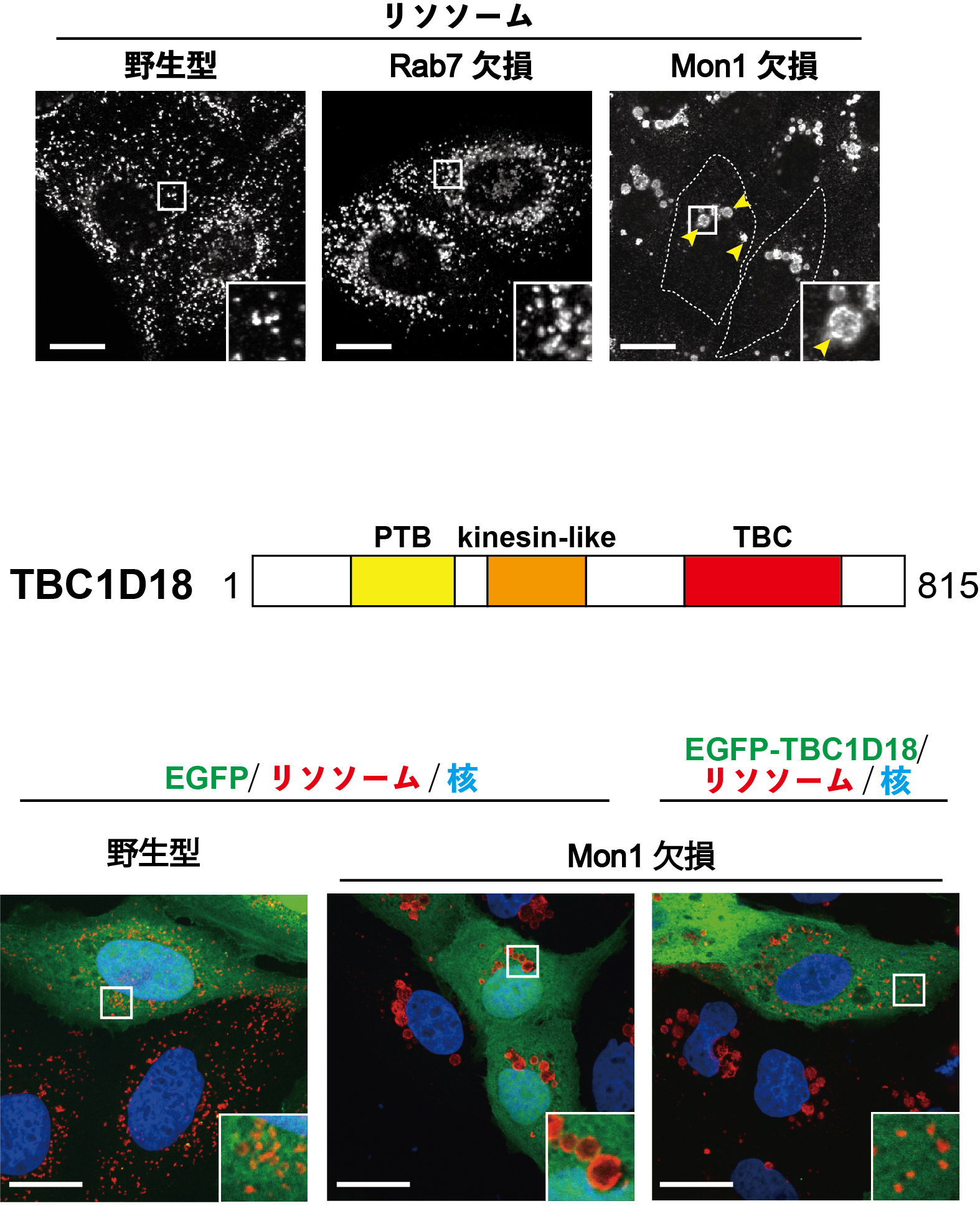
図2 Mon1欠損細胞におけるリソソームの肥大化とTBC1D18の発現による回復効果
A) 野生型細胞、Rab7欠損細胞、Mon1欠損細胞におけるリソソームの染色画像。Mon1欠損細胞では、野生型やRab7欠損細胞に比べてリソソームが顕著に肥大化(矢頭)している。スケールバー:20 μm
B) TBC1D18のドメイン構造。アミノ末端側から、PTBドメイン、kinesin-likeドメイン、及びRabの不活性化に関わるTBCドメインを持つ。
C) Mon1欠損細胞にTBC1D18を発現した際のリソソームの染色画像。Mon1の欠損により肥大化していたリソソームが、TBC1D18の発現で野生型細胞の大きさまで小さくなっている。スケールバー:20 μm
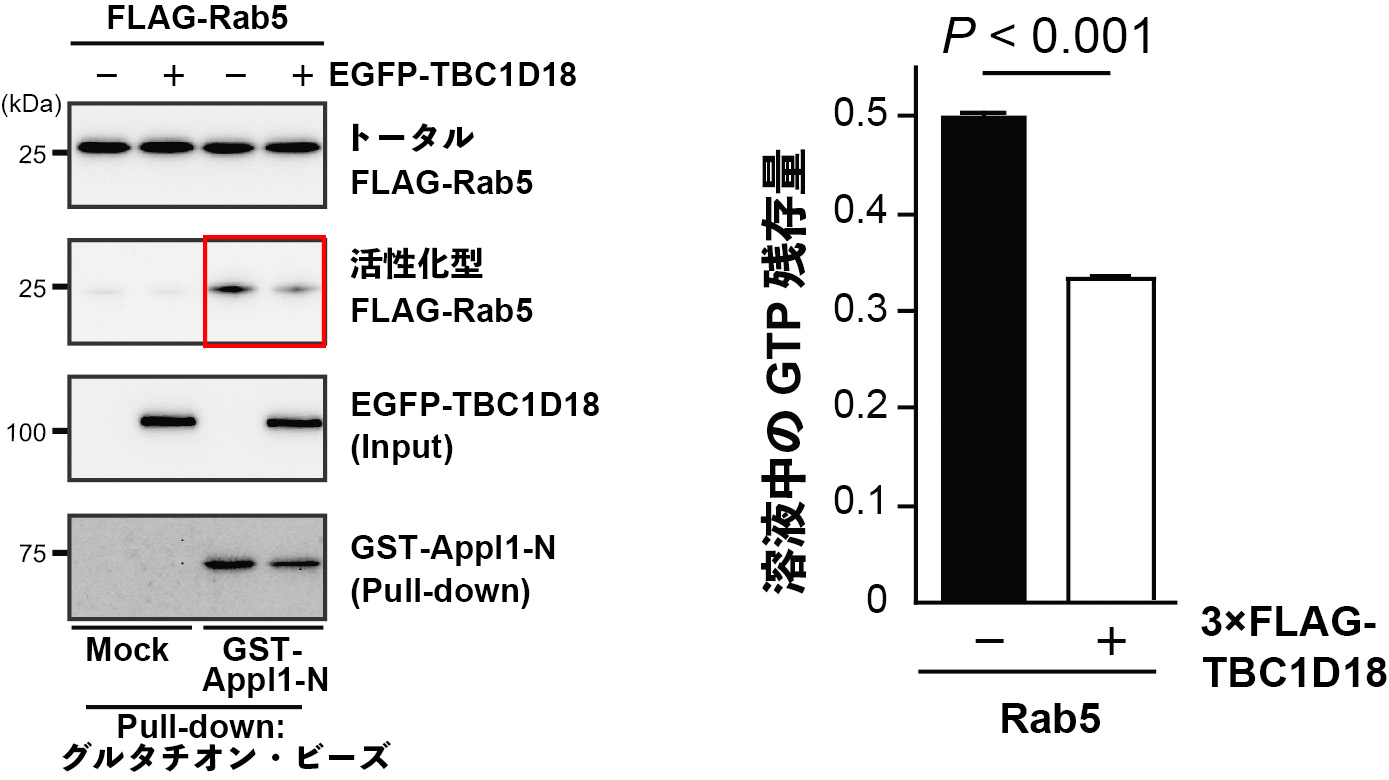
図3 TBC1D18によるRab5の不活性化
A) TBC1D18の発現による細胞内の活性化型Rab5の減少。細胞内の活性化型Rab5をビーズに固定化したGST-Appl1-Nでトラップし、免疫ブロット法により検出した。赤枠で示すように、TBC1D18の発現によって活性化型のRab5の量が減少している。
B) TBC1D18による試験管内(in vitro)でのRab5の不活性化(溶液中のGTP量の減少)。精製したTBC1D18がRab5によるGTPの加水分解(GDPと無機リン酸(Pi)に分解)を促進した結果、溶液中のGTP量が有意に減少している。
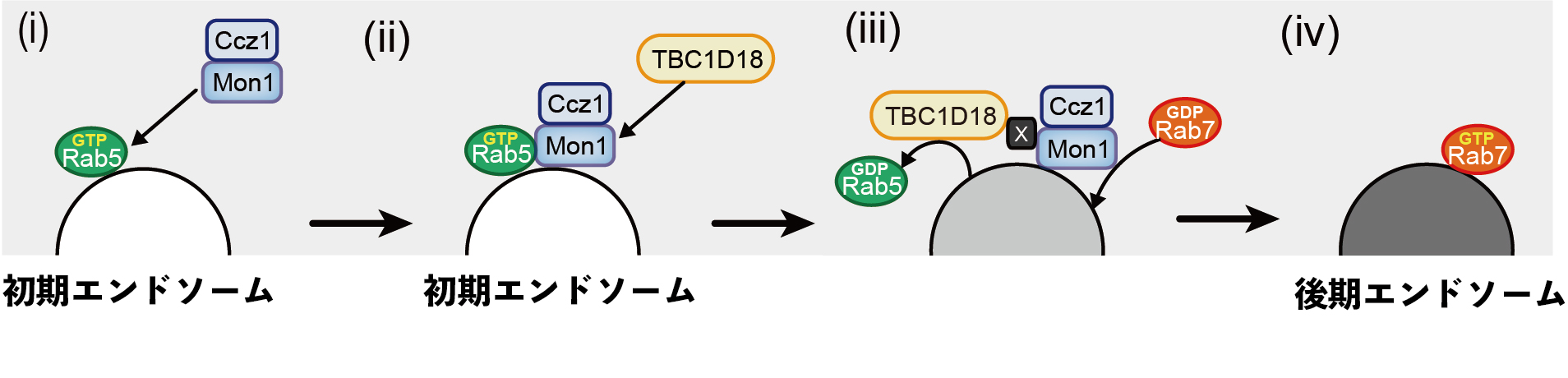
図4 エンドソーム成熟モデル図
(i) 初期エンドソーム上で活性化したRab5によって、Mon1-Ccz1複合体が初期エンドソームにリクルートされる。(ii) Mon1-Ccz1複合体が因子Xを介してTBC1D18をリクルートする。(iii) Mon1-Ccz1複合体がRab7を活性化し、TBC1D18がRab5を不活性化させる。(iv) 後期エンドソーム上でRab7が機能し、エンドソームの成熟が促進する。
【論文情報】
Shu Hiragi, Takahide Matsui, Yuriko Sakamaki & Mitsunori Fukuda. (2022) TBC1D18 is a Rab5-GAP that coordinates endosome maturation together with Mon1. Journal of Cell Biology. DOI: 10.1083/jcb.202201114
【問い合わせ先】
(研究に関すること)
東北大学大学院生命科学研究科
担当 福田 光則 (ふくだ みつのり)
電話番号: 022-795-7731
Eメール: nori(at)tohoku.ac.jp
(報道に関すること)
東北大学大学院生命科学研究科広報室
担当 高橋 さやか (たかはし さやか)
電話番号: 022-217-6193
Eメール: lifsci-pr(at)grp.tohoku.ac.jp

